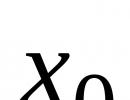). L.P.Ivanova, Novinsk o'rta maktabining kimyo o'qituvchisi (Astraxan viloyati) Metalllarning davriy sistemadagi o'rni
D.I.Mendeleyevning elementlar davriy sistemasida metallar B-At diagonalining pastki chap burchagida joylashgan.
Metallar sinfi elementlar tomonidan hosil bo'ladi s- oilalar (H va Hedan tashqari), p-asosiy kichik guruhlar III (B tashqari), IV (Ge, Sn, Pb), V (Sb, Bi) va VI (Po) elementlari, barchasi d- Va f-elementlar. Diagonalga yaqin joylashgan elementlar (Be, Al, Ti, Ge) ikki tomonlama xarakterga ega. Elementlarning davriy sistemasida metallar koʻpchilikni tashkil qiladi (109 ta elementdan faqat 22 tasi metall boʻlmagan).
Tashqi elektron sathida yadro bilan zaif bog'langan 1, 2 yoki 3 elektron mavjud.
11 Na +11))) 20 Ca +20)))) 13 Al +13)))
2 8 1 2 8 8 2 2 8 3
1s 2 2s 2 2p 6 3s 1 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 1s 2 2s 2 2p 6 3s 3
Metalllarda metall va metall kristall panjara orasidagi bog'lanish metallarning fizik xususiyatlarini tushuntiradi.
Asosiy kichik guruhlar uchun: metall qanchalik chapga va pastroq bo'lsa, uning kimyoviy faolligi shunchalik yuqori bo'ladi. Davrlarda metall xossalari pasayadi, guruhlarda esa atomning radiusi o'zgarganda (atom sonining ortishi bilan) ortadi.
Metalllar umumiy fizik xususiyatlarga ega:
1) qattiqlik; 2) elektr va issiqlik o'tkazuvchanligi; 3) shaffoflik; 4) metall yorqinligi;
5) egiluvchanlik yoki plastiklik (tushuntirish - metall kristall panjara).
Kimyoviy xossalari: , n=1,2,3. (metall har doim qaytaruvchi moddalardir)
I . Oddiy moddalar bilan:
1) kislorod bilan:
a) 2Ca + O 2 → 2CaO b) 2Mg + O 2 2MgO c) Au + O 2 ↛
Xo'sh, ko'plab metallar keyingi oksidlanishni oldini oladigan nozik bir plyonka bilan qoplangan.
2) halogenlar bilan:
a) 2Na + Cl 2 → 2NaCl b) 2Fe + 3Cl2 FeCl3
3) oltingugurt bilan: Fe + S → FeS
II. Murakkab moddalar bilan (metall faollik diapazoni):
1) suv bilan:
a) (ishqoriy va ishqoriy tuproq metallar uchun) 2Na + 2H 2 O → 2NaOH + H 2
b) o'rta faollikdagi metallar Mg + H 2 O MgO + H 2
c) vodorod Au + H 2 O ↛ o'ng tomonida
2) kislota eritmalari bilan, HNO 3 dan tashqari
a) Zn + 2HCl → ZnCl 2 + H 2 b) Cu + HCl ↛
3) tuzlar bilan: Fe + CuSO 4 → FeSO 4 + Cu
Ilova:
1) kundalik hayotda - idish-tovoq, maishiy texnika; 2) texnikada, sanoatda;
3) aviatsiya va raketasozlikda; 4) tibbiyotda va boshqalar.
Chipta № 9 (2)
Fenol, uning tuzilishi, xossalari, olinishi va ishlatilishi.
 Fenol bir vodorod atomi OH guruhi bilan almashtirilgan benzol hosilasidir.
Fenol bir vodorod atomi OH guruhi bilan almashtirilgan benzol hosilasidir.
Benzol halqasi va OH guruhlarining o'zaro ta'siri:
1) C 6 H 5 radikali OH kislorod atomidan elektronlarni jalb qilish xususiyatiga ega. - guruhlar, bu O-H aloqasini yanada qutbli va vodorod atomini yanada harakatchan qiladi.
2) U - guruh 2,4,6 - benzol halqasidagi vodorod atomlariga katta harakatchanlikni beradi.
Bu o'zaro ta'sir fenolning xususiyatlarini aniqlaydi.
Fenol - rangsiz, kristalli modda shifoxonaning o'ziga xos hidi bilan.
Erish nuqtasi 40,9 ℃, issiq suvda (karbol kislotasi) juda eriydi.
Fenol zaharli!
Kimyoviy xossalari:
1) Suvda ionlarga ajraladi:
2) Zaif kislotali xususiyatlarni ko'rsatadi, metallar bilan reaksiyaga kirishadi:
2C 6 H 5 OH + 2Na → 2C 6 H 5 ONa + H 2
natriy fenolat
3) Ishqor bilan reaksiyaga kirishadi:
C 6 H 5 OH + NaOH → C 6 H 5 ONa + H 2 O (spirtli ichimliklardan farqi)
4) Almashtirish reaksiyalari:
Sanoatda fenol olish sxema bo'yicha:

 1) 2)
1) 2)
Fenol murojaat qiling ishlab chiqarish uchun:
1) polimerlar va ular asosidagi plastmassalar, bo'yoqlar;
2) dori vositalari;
3) portlovchi moddalar. Dezinfektsiyalash vositasi sifatida fenolning vodorod eritmasi ishlatiladi.
Chipta № 10 (1)
1. Metalllarning elementlar jadvalidagi joylashuvi
Metalllar asosan PSHE ning chap va pastki qismlarida joylashgan. Bularga quyidagilar kiradi:
2. Metall atomlarining tuzilishi
Metall atomlari odatda tashqi energiya darajasida 1-3 elektronga ega. Ularning atomlari katta radiusga ega va valentlik elektronlaridan osongina voz kechadi, ya'ni. tiklovchi xususiyatlarni namoyon qiladi.

3. Metalllarning fizik xossalari

Metall qizdirilganda va sovutilganda uning elektr o'tkazuvchanligining o'zgarishi
Metall ulanish - bu erkin elektronlar metall kristall panjaradagi kationlar o'rtasida amalga oshiradigan bog'lanishdir.
4. Metalllarni olish
1. Metalllarni oksidlardan ko'mir yoki uglerod oksidi bilan kamaytirish
Me x O y + C = CO 2 + Me yoki Me x O y + CO = CO 2 + Me
2. Sulfidlarni qovurish, keyin kamaytirish
1-bosqich – Me x S y +O 2 =Me x O y +SO 2
2-bosqich -Me x O y + C = CO 2 + Men yoki Men x O y + CO = CO 2 + Men
3 Aluminotermiya (faolroq metall bilan qisqartirish)
Men x O y + Al = Al 2 O 3 + Me
4. Gidrotermiya - yuqori toza metallar ishlab chiqarish uchun
Men x O y + H 2 = H 2 O + Me
5. Elektr toki bilan metallarning qaytarilishi (elektroliz)
1) Ishqoriy va ishqoriy tuproq metallari sanoatda elektroliz yoʻli bilan olinadi erigan tuzlar (xloridlar):
2NaCl - eritish, tanlash. joriy. → 2 Na + Cl 2
CaCl 2 - eritish, tanlash. joriy.→ Ca+Cl2
gidroksid eriydi:
4NaOH - eritish, tanlash. joriy.→ 4 Na + O 2 + 2 H 2 O
2) alyuminiy sanoatda elektroliz yoʻli bilan olinadi alyuminiy oksidi eritmasi I Na 3 AlF 6 kriolitda (boksitdan):
2Al 2 O 3 – kriolitda erish, elektr. joriy.→ 4 Al + 3 O 2
3) Suvli tuz eritmalarining elektrolizi foydalanish oraliq faollikdagi va faol bo'lmagan metallarni olish uchun:
2CuSO 4 +2H 2 O – eritma, tanlangan. joriy.→ 2 Cu + O 2 + 2 H 2 SO 4
5. Tabiatdagi metallarni topish
Er qobig'idagi eng keng tarqalgan metall alyuminiydir. Metalllar ham birikmalarda, ham erkin shaklda uchraydi.
1. Faol - tuzlar (sulfatlar, nitratlar, xloridlar, karbonatlar) shaklida.
2. O'rtacha faollik - oksidlar, sulfidlar shaklida ( Fe 3 O 4 , FeS 2 )
3. Noble – erkin shaklda ( Au, Pt, Ag)METALLARNING KIMYOVIY XUSUSIYATLARI
Metalllarning umumiy kimyoviy xossalari jadvalda keltirilgan:

TOPSHIRISH VAZIFALARI
№ 1. Tenglamalarni yakunlang amaliy reaksiyalar, reaksiya mahsulotlarini nomlang
Li+ H 2 O =
Cu + H2O =
Al + H 2 O =
Ba + H2O =
Mg + H2O =
Ca+HCl=
Na + H 2 SO 4 (K) =
Al + H 2 S=
Ca + H3PO4 =
HCl + Zn =
H 2 SO 4 (k)+ Cu=
H 2 S + Mg =
HCl + Cu =
HNO 3 (K)+ S u =
H2S+Pt=
H3PO4 + Fe =
HNO 3 (p)+ Na=
№ 2. CRMni to'ldiring, elektron balans usuli yordamida koeffitsientlarni tartibga soling, oksidlovchi vositani (qaytaruvchi vositani) ko'rsating:
Al + O 2 =
Li + H 2 O =
Na + HNO 3 (k) =
Mg + Pb(NO 3) 2 =
Ni + HCl =
Ag + H 2 SO 4 (k) =№ 3. Nuqtalar o'rniga etishmayotgan belgilarni qo'ying (<, >yoki =)
Asosiy zaryad | Li…Rb | Na…Al | Ca…K |
Energiya darajalari soni | Li…Rb | Na…Al | Ca…K |
Tashqi elektronlar soni | Li…Rb | Na…Al | Ca…K |
Atom radiusi | Li…Rb | Na…Al | Ca…K |
Qayta tiklovchi xususiyatlar | Li…Rb | Na…Al | Ca…K |
№ 4. CRMni to'ldiring, elektron balans usuli yordamida koeffitsientlarni tartibga soling, oksidlovchi vositani (qaytaruvchi vositani) ko'rsating:
K+ O 2 =
Mg+ H 2 O =
Pb+ HNO 3 (p) =
Fe+ CuCl 2 =
Zn + H 2 SO 4 (p) =
Zn + H 2 SO 4 (k) =
№ 5. Test masalalarini hal qilish
|
1.Faqat metallardan iborat elementlar guruhini tanlang: A) Al, As, P; B) Mg, Ca, Si; B ) K, Ca, Pb 2. Faqat oddiy moddalar - metall bo'lmaganlar bo'lgan guruhni tanlang: A) K 2 O, SO 2, SiO 2; B) H 2, Cl 2, I 2; B ) Ca, Ba, HCl; 3. K va Li atomlarining tuzilishidagi umumiy xususiyatlarni ko‘rsating: A) oxirgi elektron qatlamda 2 ta elektron; B) oxirgi elektron qatlamda 1 ta elektron; C) elektron qatlamlarning bir xil soni. 4. Kaltsiy metalli quyidagi xossalarni namoyon qiladi: A) oksidlovchi modda; B) qaytaruvchi vosita; C) sharoitga qarab oksidlovchi yoki qaytaruvchi. 5. Natriyning metall xossalari -ga qaraganda zaifroqdir. A) magniy;B) kaliy;C) litiy. 6. Faol bo'lmagan metallarga quyidagilar kiradi: A) alyuminiy, mis, rux;B) simob, kumush, mis; C) kalsiy, berilliy, kumush. 7. Jismoniy xususiyat nimadan iborat emas Barcha metallar uchun umumiy: A) elektr o'tkazuvchanligi, B) issiqlik o'tkazuvchanligi, B) agregatsiyaning qattiq holatida normal sharoitlar, D) metall porlashi |
|
B qismi. Bu qismdagi vazifalarga javob yozilishi kerak bo'lgan harflar to'plamidir Match. Davriy tizimning II guruhining asosiy kichik guruhidagi elementning tartib raqamining ko'payishi bilan elementlarning xossalari va ular hosil qiladigan moddalar quyidagicha o'zgaradi: |
Kirish Metalllar - oddiy sharoitda xarakterli xususiyatlarga ega bo'lgan oddiy moddalar: yuqori elektr va issiqlik o'tkazuvchanligi, yorug'likni yaxshi aks ettirish qobiliyati (bu ularning yorqinligi va shaffofligini keltirib chiqaradi) va tashqi kuchlar ta'sirida kerakli shaklni olish qobiliyati. (plastiklik). Metalllarning yana bir ta'rifi bor - bular tashqi (valentlik) elektronlarni berish qobiliyati bilan tavsiflangan kimyoviy elementlardir. kimyoviy elementlar 90 ga yaqini metallardir. Aksariyat noorganik birikmalar metall birikmalaridir.
Metalllarni tasniflashning bir necha turlari mavjud. Eng aniq metallarning kimyoviy elementlarning davriy tizimidagi o'z o'rniga ko'ra tasnifi - kimyoviy tasnif. Agar davriy jadvalning "uzun" variantida biz bor va astatin elementlari orqali to'g'ri chiziq o'tkazadigan bo'lsak, unda bu chiziqning chap tomonida metallar, o'ng tomonida esa metall bo'lmaganlar bo'ladi. atomning tuzilishiga ko'ra, metallar o'tmaydigan va o'tishga bo'linadi.
O'tishga to'g'ri kelmaydigan metallar davriy tizimning asosiy kichik guruhlarida joylashgan bo'lib, ularning atomlarida s va p elektron darajalari ketma-ket to'ldirilganligi bilan tavsiflanadi. O‘tish o‘tkazmaydigan metallar a asosiy kichik guruhlarning 22 ta elementini o‘z ichiga oladi: Li, Na, K, Rb, Cs, Fr, Be, Mg, Ca, Sr, Ba, Ra, Al, Ga, In, Tl, Ge, Sn, Pb. , Sb, Bi, Po. O'tish metallari ikkilamchi kichik guruhlarda joylashgan bo'lib, d- yoki f-elektron darajalarini to'ldirish bilan tavsiflanadi.
d-elementlarga ikkilamchi kichik guruh b ning 37 ta metallari kiradi: Cu, Ag, Au, Zn, Cd, Hg, Sc, Y, La, Ac, Ti, Zr, Hf, Rf, V, Nb, Ta, Db, Cr, Mo , W, Sg, Mn, Tc, Re, Bh, Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Pt, Hs, Mt. f-elementlarga 14 ta lantanid (Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Du, Ho, Er, Tm, Yb, Lu) va 14 aktinid (Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, Yo'q, Lr). Oʻtish metallari orasida nodir tuproq metallari (Sc, Y, La va lantanidlar), platina metallari (Ru, Rh, Pd, Os, Ir, Pt), transuran metallari (Np va atom massasi yuqori boʻlgan elementlar) ham ajralib turadi. Kimyoviydan tashqari, umumiy qabul qilinmasa ham, metallarning uzoq vaqtdan beri tasdiqlangan texnik tasnifi mavjud.
Bu kimyoviy kabi mantiqiy emas, u metallning u yoki bu amaliy muhim xususiyatiga asoslanadi. Temir va uning asosidagi qotishmalar qora metallarga, qolgan barcha metallar esa rangli metallarga, yengil metallar (Li, Be, Mg, Ti va boshqalar) mavjud. og'ir metallar(Mn, Fe, Co, Ni, Cu, Zn, Cd, Hg, Sn, Pb va boshqalar), shuningdek refrakter guruhlar (Ti, Zr, Hf, V, Nb, Ta, Cr, Mo, W, Re). ), qimmatbaho (Ag, Au, platina metallari) va radioaktiv (U, Th, Np, Pu va boshqalar) metallar.
Geokimyoda dispers (Ga, Ge, Hf, Re va boshqalar) va kam uchraydigan (Zr, Hf, Nb, Ta, Mo, W, Re va boshqalar) metallar ham farqlanadi.Ko’rinib turibdiki, aniq yo’q. guruhlar orasidagi chegaralar. Tarixiy ma'lumotnoma Garchi hayot insoniyat jamiyati metallarsiz mumkin emas, hech kim ularni qachon va qanday qilib birinchi marta ishlata boshlaganini aniq bilmaydi.
Bizgacha yetib kelgan eng qadimiy yozuvlarda metall eritilgan va undan mahsulotlar tayyorlangan ibtidoiy ustaxonalar haqida hikoya qilinadi. Bu shuni anglatadiki, inson yozishdan oldin metallarni o'zlashtirgan. Qadimgi aholi punktlarini qazishda arxeologlar oʻsha olis zamonlarda odamlar ishlatgan mehnat qurollari-pichoq, bolta, oʻq uchlari, ignalar, qarmoqlar va boshqa koʻp narsalarni topadilar.Aholi punktlari qanchalik qadimgi boʻlsa, inson qoʻli bilan yaratilgan mahsulotlar shunchalik qoʻpol va ibtidoiy boʻlgan. Eng qadimgi metall buyumlar taxminan 8 ming yil oldin mavjud bo'lgan aholi punktlarini qazish paytida topilgan.
Bular, asosan, oltin va kumushdan yasalgan taqinchoqlar hamda misdan yasalgan oʻq uchlari va nayzalar edi. Yunoncha "metallon" so'zi dastlab minalar degan ma'noni anglatadi, shuning uchun "metall" atamasi. Qadim zamonlarda atigi 7 ta metal borligiga ishonishgan: oltin, kumush, mis, qalay, qo'rg'oshin, temir va simob.Bu raqam o'sha paytda ma'lum bo'lgan sayyoralar soniga bog'liq edi - Quyosh (oltin), Oy ( kumush), Venera (mis), Yupiter ( qalay), Saturn (qo'rg'oshin), Mars (temir), Merkuriy (simob) (rasmga qarang). Alkimyoviy g'oyalarga ko'ra, metallar sayyoralar nurlari ta'sirida erning ichaklarida paydo bo'lgan va asta-sekin yaxshilanib, oltinga aylangan.
Inson dastlab mahalliy metallarni - oltin, kumush, simobni o'zlashtirdi.Birinchi sun'iy yo'l bilan ishlab chiqarilgan metall mis bo'lib, keyin bulbul tomonidan mis qotishmasi - bronza va keyinchalik - temir ishlab chiqarishni o'zlashtirdi.
1556 yilda nemis metallurgi G. Agrikolaning "Tog'-kon va metallurgiya to'g'risida" kitobi Germaniyada nashr etildi - bizgacha yetib kelgan birinchi kitob. batafsil qo'llanma metallar ishlab chiqarish uchun. To‘g‘ri, o‘sha paytda ham qo‘rg‘oshin, qalay va vismut bir metallning navlari hisoblanar edi.1789-yilda fransuz kimyogari A.Lavuazye o‘zining kimyoga oid qo‘llanmasida oddiy moddalar ro‘yxatini keltirgan bo‘lib, unga o‘sha paytda ma’lum bo‘lgan barcha metallar – surma kiritilgan edi. , kumush, vismut, kobalt, qalay, temir, marganets, nikel, oltin, platina, qo'rg'oshin, volfram va rux. Kimyoviy tadqiqot usullari rivojlangan sari, ma'lum bo'lgan metallar soni tez sur'atlar bilan ko'paya boshladi. 18-asrda 14 ta metallar, 19 tasida 38 ta, 20 tasida 25 ta metallar topilgan.
19-asrning birinchi yarmida. Platinaning sun'iy yo'ldoshlari topildi, elektroliz yo'li bilan gidroksidi va ishqoriy tuproq metallari olindi. Asr oʻrtalarida spektral analiz yordamida seziy, rubidiy, talliy va indiy topildi.D.I.Mendeleyev oʻzining davriy qonuni asosida bashorat qilgan metallarning mavjudligi (bular galiy, skandiy va germaniy) yorqin tarzda tasdiqlandi. 19-asr oxirida radioaktivlikning kashf etilishi. radioaktiv metallarni izlashga olib keldi.
Nihoyat, 20-asrning o'rtalarida yadroviy transformatsiyalar usuli bilan. tabiatda mavjud bo'lmagan radioaktiv metallar, xususan, transuran elementlari olindi. Metalllarning fizikaviy va kimyoviy xossalari.Hamma metallar qattiq moddalardir (normal sharoitda suyuq boʻlgan simobdan tashqari), ular metall boʻlmaganlardan maxsus turdagi bogʻlanish (metall bogʻ) bilan farqlanadi. Valentlik elektronlari ma'lum bir atomga zaif bog'langan va har bir metalning ichida elektron gaz deb ataladigan narsa mavjud. Ko'pgina metallar kristalli tuzilishga ega va metallni musbat ionlarning (kationlarning) "qattiq" kristall panjarasi deb hisoblash mumkin. Ushbu elektronlar metall atrofida ko'proq yoki kamroq harakatlanishi mumkin.
Ular kationlar orasidagi itaruvchi kuchlarni qoplaydi va shu bilan ularni ixcham jismga bog'laydi. Barcha metallar elektr o'tkazuvchanligi yuqori (ya'ni, ular dielektrik bo'lgan metall bo'lmagan metallardan farqli o'laroq o'tkazgichlardir), ayniqsa mis, kumush, oltin, simob va alyuminiy; Metalllarning issiqlik o'tkazuvchanligi ham yuqori.
Ko'pgina metallarning o'ziga xos xususiyati ularning egiluvchanligi (egiluvchanligi) bo'lib, buning natijasida ular yupqa qatlamlarga (folga) o'ralishi va simga (qalay, alyuminiy va boshqalar) tortilishi mumkin, ammo juda mo'rt metallar ham mavjud ( rux, surma, vismut). Sanoatda ular ko'pincha sof metallardan emas, balki qotishmalar deb ataladigan aralashmalardan foydalanadilar.
Qotishmada bir komponentning xususiyatlari odatda ikkinchisining xususiyatlarini muvaffaqiyatli to'ldiradi. Shunday qilib, mis past qattiqlikka ega va mashina qismlarini ishlab chiqarish uchun yaroqsiz, guruch deb ataladigan mis va rux qotishmalari allaqachon ancha qattiq bo'lib, mashinasozlikda keng qo'llaniladi.Alyuminiy yaxshi egiluvchanlik va etarlicha yengillik (past zichlik), lekin juda yumshoq. Uning asosida mis, magniy va marganetsni o'z ichiga olgan ayuralum (duralumin) qotishmasi tayyorlanadi.
Duralumin o'zining alyuminiy xususiyatlarini yo'qotmasdan, yuqori qattiqlikka ega bo'ladi va shuning uchun samolyot texnologiyasida qo'llaniladi. Temirning uglerodli qotishmalari (va boshqa metallarning qo'shimchalari) taniqli quyma temir va po'latdir. Metalllarning zichligi juda katta farq qiladi: litiy uchun u suvning deyarli yarmi (0,53 g / sm3), osmiy uchun esa 20 barobardan ortiq (22,61 g / sm3). Metalllar qattiqligi bilan ham farqlanadi.Eng yumshoqlari ishqoriy metallardir, ular pichoq bilan oson kesiladi; Eng qattiq metall - xrom shishani kesadi.
Metalllarning erish nuqtalarida katta farq bor: simob normal sharoitda suyuqlikdir, seziy va galliy inson tanasining haroratida eriydi va eng o'tga chidamli metall volframning erish nuqtasi 3380 ° S ni tashkil qiladi. Erish nuqtasi 1000 ° C dan yuqori bo'lgan metallar o'tga chidamli metallar deb tasniflanadi va undan past bo'lganlar eruvchan hisoblanadi.Yuqori haroratda metallar elektronlar chiqarishga qodir bo'lib, ular elektronika va termoelektr generatorlarida issiqlik energiyasini to'g'ridan-to'g'ri elektr energiyasiga aylantirish uchun ishlatiladi. energiya.
Temir, kobalt, nikel va gadoliniy ularni magnit maydonga joylashtirgandan so'ng doimiy ravishda magnitlanish holatini saqlab turishga qodir. Metalllar ham ba'zi kimyoviy xususiyatlarga ega. Metall atomlari nisbatan osonlik bilan valentlik elektronlaridan voz kechib, musbat zaryadlangan ionlarga aylanadi. Shuning uchun metallar qaytaruvchi moddalardir. Bu, aslida, ularning asosiy va eng umumiy kimyoviy xossasidir.. Shubhasiz, metallar qaytaruvchi sifatida turli oksidlovchi moddalar bilan reaksiyaga kirishadi, ular orasida oddiy moddalar, kislotalar, faolligi kamroq metallarning tuzlari va boshqa ba'zi birikmalar bo'lishi mumkin.
Metalllarning galogenli birikmalari galogenidlar, oltingugurt bilan - sulfidlar, azot bilan - nitridlar, fosfor bilan - fosfidlar, uglerod bilan - karbidlar, kremniy bilan - silisidlar, bor bilan - boridlar, vodorod bilan - gidridlar va boshqalar deb ataladi. Bu birikmalarning ko'pchiligi. topildi muhim dastur yangi texnologiyada. Masalan, metall boridlar radioelektronikada, shuningdek, yadroviy muhandislikda neytron nurlanishini tartibga solish va himoya qilish uchun materiallar sifatida ishlatiladi. Konsentrlangan oksidlovchi kislotalar ta'sirida ba'zi metallarda barqaror oksidli plyonka ham hosil bo'ladi.
Bu hodisa passivlanish deb ataladi.Demak, konsentrlangan sulfat kislotada Be, Bi, Co, Fe, Mg, Nb kabi metallar passivlanadi (va u bilan reaksiyaga kirishmaydi), konsentrlangan nitrat kislotada esa Al, Be, metallar, Bi, Co, Cr, Fe, Nb, Ni, Pb, Th va U. Metall shu qatorda qanchalik chapga joylashgan bo'lsa, u shunchalik katta qaytaruvchi xususiyatlarga ega bo'ladi, ya'ni u oson oksidlanadi va eritmaga o'tadi. kation, lekin uni kationdan erkin holatga keltirish qiyinroq.
Voltaj qatoriga bitta metall bo'lmagan vodorod joylashtirilgan, chunki bu metallning suvli eritmadagi oksidlanmaydigan kislotalar bilan reaksiyaga kirishishini aniqlashga imkon beradi (aniqrog'i, vodorod kationlari H+ bilan oksidlanadi). Masalan, rux xlorid kislotasi bilan reaksiyaga kirishadi, chunki kuchlanishlar qatorida u vodoroddan chap tomonda (oldin) joylashgan.
Aksincha, kumush xlorid kislota bilan eritmaga o'tmaydi, chunki u vodorodning o'ng tomonida (keyin) kuchlanish qatorida joylashgan. Metalllar suyultirilgan sulfat kislotada ham xuddi shunday tutadi.Vodoroddan keyingi kuchlanish qatoridagi metallar olijanob (Ag, Pt, Au va boshqalar) deb ataladi.Metallarning kiruvchi kimyoviy xossasi ularning elektrokimyoviy korroziyasi, ya’ni metallning faol yo‘q qilinishi (oksidlanishi)dir. suv bilan aloqa qilish va unda erigan kislorod ta'sirida (kislorod korroziyasi). Masalan, temir mahsulotlarining suvda korroziyasi keng tarqalgan. Ayniqsa, korroziy xavfli ikkita o'xshash bo'lmagan metallarning aloqa joyi bo'lishi mumkin - kontaktli korroziya.
Galvanik juftlik Fe kabi bir metall va suvga joylashtirilgan Sn yoki Cu kabi boshqa metall o'rtasida sodir bo'ladi. Elektronlar oqimi kuchlanish seriyasida (Fe) chapda joylashgan faolroq metalldan kamroq faol metallga (Sn, Cu) o'tadi va faolroq metall yo'q qilinadi (korroziyaga uchraydi). Shu sababli konservalangan konserva yuzasi (qalay bilan qoplangan temir) nam muhitda saqlangan va ehtiyotsizlik bilan ishlaganda zanglab ketadi (temir hatto kichik tirnalgandan keyin ham tezda qulab tushadi, bu esa dazmolning namlik bilan aloqa qilishiga imkon beradi). Aksincha, temir chelakning galvanizli yuzasi uzoq vaqt zanglamaydi, chunki tirnalgan bo'lsa ham, temir emas, balki sink (temirdan ko'ra faolroq metall) korroziyaga uchraydi. Berilgan metallning korroziyaga chidamliligi faolroq metall bilan qoplanganida yoki ular eritilganda ortadi; Shunday qilib, temirni xrom bilan qoplash yoki temir va xrom qotishmalarini tayyorlash temirning korroziyasini yo'q qiladi.
Xromli temir va xrom o'z ichiga olgan po'latlar (zanglamaydigan po'latlar) yuqori korroziyaga chidamliligiga ega.
Metalllarni olishning umumiy usullari: - elektrometallurgiya, ya'ni eritmalarni (eng faol metallar uchun) yoki ularning tuzlari eritmalarini elektroliz qilish yo'li bilan metallarni olish; - pirometallurgiya, ya'ni ularning rudalaridan metallarni olish yuqori harorat(masalan, domna jarayoni yordamida temir olish); - gidrometallurgiya, ya'ni metallarni ularning tuzlari eritmalaridan faolroq metallar bilan ajratish (masalan, rux, temir yoki alyuminiyni almashtirish orqali CuSO4 eritmasidan mis ishlab chiqarish). Tabiatda metallar ba'zan erkin shaklda, masalan, mahalliy simob, kumush va oltin, ko'pincha birikmalar (metall rudalari) shaklida uchraydi. Eng faol metallar, albatta, er qobig'ida faqat bog'langan holda mavjud. Litiy. Litiy (yunoncha Lithos — tosh), Li, davriy sistemaning Ia kichik guruhining kimyoviy elementi; atom raqami 3 atom massasi 6, 941; ishqoriy metallarni nazarda tutadi.
U 150 dan ortiq minerallarda uchraydi, shundan 30 ga yaqini litiy minerallari.Asosiy minerallar spodumen LiAl, lepidolit KLi1,5 Al1,5(F.0H)2 va petalit (LiNa). Ushbu minerallarning tarkibi murakkab, ularning ko'pchiligi er qobig'ida juda keng tarqalgan aluminosilikatlar sinfiga kiradi.
Litiy ishlab chiqarish uchun xom ashyoning istiqbolli manbalari tuzli konlarning sho'rlari (sho'rlari) va Er osti suvlari. Litiy birikmalarining eng yirik konlari Kanada, AQSH, Chili, Zimbabve, Braziliya, Namibiya va Rossiyada joylashgan.Qizigʻi shundaki, spodumen minerali tabiatda bir necha tonna ogʻirlikdagi yirik kristallar shaklida uchraydi. AQSHdagi Etta konida uzunligi 16 m, og‘irligi 100 tonna bo‘lgan igna shaklidagi kristall topildi.Litiy haqidagi birinchi ma’lumotlar 1817-yilga to‘g‘ri keladi.Shvetsiyalik kimyogari A.Arfvedson petalit mineralini tahlil qilib, unda noma’lum ishqor topdi. bu. Arfvedsonning o'qituvchisi J. Berzelius unga "lition" (yunoncha litheos - tosh) nomini bergan, chunki o'simlik kulidan olingan kaliy va natriy gidroksidlaridan farqli o'laroq, mineralda yangi ishqor topilgan. U, shuningdek, ushbu ishqorning "asos" bo'lgan metallni litiy deb atadi. 1818 yilda ingliz kimyogari va fizigi G. Davy LiOH gidroksidni elektroliz qilish orqali litiy oldi. Xususiyatlari.
Litiy kumush-oq metalldir; m.p. 180,54 °C, bp. 1340 "C; barcha metallar ichida eng yengili, uning zichligi 0,534 g/sm - alyuminiydan 5 baravar engil va suvdan deyarli ikki baravar yengil. Litiy yumshoq va egiluvchan.
Lityum birikmalari olovni chiroyli karmin qizil rangga bo'yaydi. Bu juda sezgir usul litiyni aniqlash uchun sifat tahlilida qo'llaniladi.Litiy atomining tashqi elektron qatlamining konfiguratsiyasi 2s1 (s-element). Aralashmalarda u +1 oksidlanish darajasini ko'rsatadi. Litiy elektrokimyoviy kuchlanish seriyasida birinchi bo'lib, vodorodni nafaqat kislotalardan, balki suvdan ham siqib chiqaradi. Biroq, litiyning ko'pgina kimyoviy reaktsiyalari boshqa gidroksidi metallarga qaraganda kamroq kuchli. Litiy havo komponentlari bilan deyarli reaksiyaga kirishmaydi to'liq yo'qligi xona haroratida namlik.
200 ° C dan yuqori havoda qizdirilganda, asosiy mahsulot sifatida Li2O oksidi hosil bo'ladi (faqat Li2O2 peroksid izlari mavjud). Nam havoda u asosan Li3N nitridi hosil qiladi, havo namligi 80% dan yuqori bo'lsa, LiOH gidroksid va Li2CO3 karbonat hosil qiladi. Litiy nitridini azot oqimida metallni qizdirish orqali ham olish mumkin (litiy azot bilan bevosita birikadigan oz sonli elementlardan biridir): 6Li + N2 = 2Li3N Litiy deyarli barcha metallar bilan oson qotishadi va simobda yaxshi eriydi.
To'g'ridan-to'g'ri galogenlar bilan birlashadi (qizdirilganda yod bilan). 500 °C da vodorod bilan reaksiyaga kirishib, LiH gidridini hosil qiladi, suv bilan - LiOH gidroksid, suyultirilgan kislotalar bilan - litiy tuzlari, ammiak bilan - LiNH2 amid, masalan: 2Li + H2 = 2LiH 2Li + 2H2O = 2LiOH + H2 2Li + 2NF = 2LiF + H2 2Li + 2NH3 = 2LiNH2 + H2 LiH gidrid - rangsiz kristallar; kimyoning turli sohalarida qaytaruvchi vosita sifatida ishlatiladi.
Suv bilan o'zaro ta'sirlashganda u ko'p miqdorda vodorodni chiqaradi (1 kg LiH dan 2820 litr H2 olinadi): LiH + H2O = LiOH + H2 Bu LiH dan havo sharlari va qutqaruv uskunalarini to'ldirish uchun vodorod manbai sifatida foydalanish imkonini beradi. (shishiriladigan qayiqlar, kamarlar va boshqalar), shuningdek, yonuvchan vodorodni saqlash va tashish uchun o'ziga xos "ombor" (bu holda, LiH ni eng kichik namlik izidan himoya qilish kerak). Aralash lityum gidridlar organik sintezda keng qo'llaniladi, masalan, lityum alyuminiy gidrid LiAlH4, selektiv qaytaruvchi vosita.
LiH ning alyuminiy xlorid AlCl3 bilan reaksiyaga kirishishi natijasida olinadi LiOH gidroksid kuchli asos (ishqor), uning suvli eritmalari shisha va chinni yo'q qiladi; Nikel, kumush va oltin unga chidamli.
LiOH gidroksidi akkumulyatorlarning elektrolitiga qo'shimcha sifatida ishlatiladi, bu ularning ishlash muddatini 2-3 barobarga va quvvatini 20% ga oshiradi. LiOH va organik kislotalar (ayniqsa stearik va palmitik) asosida metallarni -40 dan +130 °C gacha bo'lgan harorat oralig'ida korroziyadan himoya qilish uchun sovuqqa va issiqlikka chidamli yog'lar (litollar) ishlab chiqariladi.Litiy gidroksid ham ishlatiladi. gaz maskalari, suv osti kemalari, samolyotlar va kosmik kemalarda karbonat angidridni yutish vositasi.
Kvitansiya va ariza. Litiy olish uchun xom ashyo uning tuzlari bo'lib, ular minerallardan olinadi.Tarkibiga qarab minerallar sulfat kislota H2SO4 (kislota usuli) yoki kaltsiy oksidi CaO va uning karbonati CaCO3 (ishqoriy usul), kaliy bilan sinterlanadi. sulfat K2SO4 (tuz usuli), kaltsiy karbonat va uning xlorid CaCl bilan (ishqoriy-tuz usuli). Kislota usuli yordamida Li2SO4 sulfat eritmasi olinadi [ikkinchisi kaltsiy gidroksid Ca(OH)2 va soda Na2Co3 bilan ishlov berish orqali aralashmalardan tozalanadi]. Mineral parchalanishning boshqa usullari bilan hosil bo'lgan kek suv bilan yuviladi; bu holda ishqoriy usul bilan LiOH eritmaga, tuz usuli bilan - Li 2SO4, gidroksidi-tuz usuli bilan - LiCl kiradi. Ishqoriydan tashqari barcha bu usullar Li2CO3 karbonat shaklida tayyor mahsulotni ishlab chiqarishni ta'minlaydi. to'g'ridan-to'g'ri yoki boshqa lityum birikmalarini sintez qilish uchun manba sifatida ishlatiladi.
Lityum metall LiCl va kaliy xlorid KCl yoki bariy xlorid BaCl2 ning erigan aralashmasini elektroliz qilish va aralashmalardan keyingi tozalash orqali ishlab chiqariladi. Litiyga qiziqish juda katta.
Bu, birinchi navbatda, vodorod bombasining asosiy tarkibiy qismi va termoyadro reaktorlari uchun asosiy yoqilg'i bo'lgan tritiy (og'ir vodorod nuklidi)ni sanoatda ishlab chiqarish manbai ekanligi bilan bog'liq.Termoyadro reaktsiyasi sodir bo'ladi. 6Li nuklidi va neytronlar o'rtasida (massa soni 1 bo'lgan neytral zarralar); reaksiya mahsulotlari - tritiy 3H va geliy 4He: 63Li + 10n= 31 H +42He Katta miqdorda litiy metallurgiyada ishlatiladi. 10% litiyli magniy qotishmasi magniyning o'zidan kuchliroq va engilroq.
Alyuminiy va litiy qotishmalari - tarkibida atigi 0,1% litiy bo'lgan skleron va aeron, engillikdan tashqari, yuqori mustahkamlik, egiluvchanlik va korroziyaga chidamliligini oshiradi; ular aviatsiyada qo'llaniladi. Qo'rg'oshinli kalsiyli qotishmalarga 0,04% li litiy qo'shilishi ularning qattiqligini oshiradi va ishqalanish koeffitsientini pasaytiradi.Litiy galogenidlari va karbonat optik, kislotaga chidamli va boshqa maxsus oynalar ishlab chiqarishda, shuningdek, issiqqa chidamli chinni va keramika, turli sir va emallar.
Litiyning kichik bo'laklari sabab bo'ladi kimyoviy kuyishlar nam teri va ko'zlar. Lityum tuzlari terini bezovta qiladi. Litiy gidroksid bilan ishlaganda, natriy va kaliy gidroksidlari bilan ishlashda bo'lgani kabi ehtiyot choralarini ko'rish kerak. Natriy.Natriy (arab, natrun, yunoncha nitron — tabiiy soda, davriy tizimning Ia kichik guruhining kimyoviy elementi; atom raqami 11, atom ogʻirligi 22,98977; ishqoriy metallarga mansub.
Tabiatda yagona barqaror nuklid, 23 Na shaklida uchraydi. Hatto qadimgi davrlarda ham natriy birikmalari ma'lum bo'lgan - osh tuzi (natriy xlorid) NaCl, gidroksidi (natriy gidroksid) NaOH va soda (natriy karbonat) Na2CO3. Oxirgi moddani qadimgi yunonlar "nitron" deb atashgan; Bu metallning zamonaviy nomi - "natriy" dan kelib chiqqan. Biroq, Buyuk Britaniya, AQSh, Italiya, Frantsiyada natriy so'zi (dan ispancha so'z"soda", rus tilidagi kabi ma'noga ega). Natriy (va kaliy) ning ishlab chiqarilishi haqida birinchi marta ingliz kimyogari va fizigi G. Deyvi 1807 yilda Londonda qirollik jamiyatining yig'ilishida ma'lum qildi. U elektr toki yordamida gidroksidi KOH va NaOH ni parchalashga va ilgari noma'lum bo'lgan metallarni ajratib olishga muvaffaq bo'ldi. ajoyib xususiyatlarga ega.
Bu metallar havoda juda tez oksidlanib, suv yuzasida suzib yurib, undan vodorod ajralib chiqdi. Tabiatda tarqalishi.Natriy tabiatda keng tarqalgan elementlardan biridir.
Uning er qobig'idagi miqdori og'irlik bo'yicha 2,64% ni tashkil qiladi. Gidrosferada u eruvchan tuzlar shaklida taxminan 2,9% (umumiy tuz konsentratsiyasi bilan) mavjud. dengiz suvi 3,5-3,7%). Quyosh atmosferasida va yulduzlararo fazoda natriy borligi aniqlangan. Tabiatda natriy faqat tuzlar holida uchraydi.Eng muhim minerallar: galit (tosh tuzi) NaCl, mirabilit (Glauber tuzi) Na2SO4 *10H2O, tenardit Na2SO4, Chelyan selitrasi NaNO3, tabiiy silikatlar, masalan, albit Na, nefelin. Na Rossiya tosh tuzi konlariga (masalan, Solikamsk, Usolye-Sibirskoye va boshqalar), Sibirdagi yirik trona mineral konlariga juda boy.
Xususiyatlari.Natriy kumush-oq, erituvchi metall, mp. 97,86 °C, bp. 883,15 °C. Bu eng engil metallardan biri - u suvdan engilroq, zichligi 0,99 g / sm3 19,7 ° C da). Natriy va uning birikmalari yondirgich alangasini sariq rangga bo'yadi. Bu reaktsiya shunchalik sezgirki, u hamma joyda (masalan, ichki yoki tashqi changda) natriyning eng kichik izlari mavjudligini aniqlaydi. Natriy davriy jadvalning eng faol elementlaridan biridir.
Natriy atomining tashqi elektron qatlami bitta elektronni o'z ichiga oladi (3s1 konfiguratsiyasi, natriy s-element). Natriy o'zining yagona valentlik elektronidan osongina voz kechadi va shuning uchun uning birikmalarida har doim +1 oksidlanish darajasini ko'rsatadi. Havoda natriy faol oksidlanib, sharoitga qarab Na2O oksidi yoki Na2O2 peroksid hosil qiladi. Shuning uchun natriy kerosin yoki mineral moy qatlami ostida saqlanadi. Vodorodni siqib chiqaradigan suv bilan kuchli reaksiyaga kirishadi: 2Na + H20 = 2NaOH + H2 Bu reaktsiya muz bilan -80 ° C haroratda ham sodir bo'ladi va iliq suv bilan yoki aloqa yuzasida portlash bilan sodir bo'ladi (bu bejiz emas. ular: "Agar jinni bo'lishni xohlamasangiz, natriyni suvga tashlamang"). Natriy to'g'ridan-to'g'ri barcha nometallar bilan reaksiyaga kirishadi: 200 ° C da u vodorodni o'zlashtira boshlaydi, juda gigroskopik gidrid NaH hosil qiladi; elektr razryadda azot bilan nitridi Na3N yoki azid NaN3 hosil qiladi; ftorli atmosferada u yonadi; haroratda xlor kuyishida; faqat qizdirilganda brom bilan reaksiyaga kirishadi: 2Na + H2 = 2NaH 6Na + N2 = 2Na3N yoki 2Na+ 3Na2 = 2NaN3 2Na+ C12 = 2NaCl 800-900 ° S da natriy uglerod bilan birikib, Na2C2 karbidini hosil qiladi; oltingugurt bilan maydalanganda Na2S sulfid va polisulfidlar aralashmasini (Na2S3 va Na2S4) beradi.Natriy suyuq ammiakda oson eriydi, natijada olingan eritma. ko'k rangda metall o'tkazuvchanligiga ega, ammiak gazi 300-400 °C da yoki katalizator ishtirokida -30 °C ga sovutilganda amid NaNH2 ni beradi.Natriy boshqa metallar bilan birikmalar hosil qiladi (metallararo birikmalar), masalan, kumush, oltin, kadmiy, qo'rg'oshin, kaliy va boshqalar.
Simob bilan u amalgamlar NaHg2, NaHg4 va boshqalarni hosil qiladi. Eng yuqori qiymat kerosin yoki mineral moy qatlami ostida joylashgan simobga natriyni bosqichma-bosqich kiritish natijasida hosil bo'lgan suyuq amalgamalarga ega.
Natriy suyultirilgan kislotalar bilan tuzlar hosil qiladi. Kvitansiya va ariza.
Natriy olishning asosiy usuli erigan osh tuzining elektrolizidir. Bunda anodda xlor, katodda esa natriy ajralib chiqadi.
Elektrolitning erish nuqtasini kamaytirish uchun osh tuziga boshqa tuzlar qo'shiladi: KCl, NaF, CaCl2. Elektroliz diafragmali elektrolizatorlarda amalga oshiriladi; anodlar grafitdan, katodlar mis yoki temirdan tayyorlanadi.Natriyni NaOH gidroksid eritmasini elektroliz qilish, oz miqdorda esa azid NaN3 ni parchalash orqali olish mumkin. Metall natriy ularning birikmalaridan sof metallarni tiklash uchun ishlatiladi - kaliy (KOH dan), titan (TiCl4 dan) va boshqalar. Natriyning kaliy bilan qotishmasi yadro reaktorlari uchun sovutuvchi vositadir, chunki gidroksidi metallar neytronlarni yaxshi singdirmaydi va shuning uchun uran yadrolarining bo'linishiga to'sqinlik qilmaydi.
To'ldirish uchun yorqin sariq rangga ega bo'lgan natriy bug'i ishlatiladi gaz chiqarish lampalari, avtomagistrallarni, iskalalarni, vokzallarni va boshqalarni yoritish uchun ishlatiladi.Natriy tibbiyotda qo'llaniladi: sun'iy ravishda ishlab chiqarilgan nuklid 24Na leykemiyaning ba'zi shakllarini radiologik davolashda va diagnostika maqsadlarida qo'llaniladi. Natriy birikmalaridan foydalanish ancha kengroq.
Na2O2 peroksid rangsiz kristall, sariq rangli texnik mahsulotdir. 311-400 ° S gacha qizdirilganda u kislorodni chiqara boshlaydi va 540 ° C da tez parchalanadi. Kuchli oksidlovchi modda, shu tufayli u gazlama va boshqa materiallarni oqartirish uchun ishlatiladi.Havoda u CO2 ni o'ziga singdirib, kislorodni chiqaradi va karbonat 2Na2O2+2CO2=2Na2Co3+O2 hosil qiladi). Na2O2 dan yopiq joylarda va izolyatsiyalovchi nafas olish qurilmalarida (suv osti kemalari, izolyatsion gaz maskalari va boshqalar) havo regeneratsiyasi uchun foydalanish ushbu xususiyatga asoslanadi. NaOH gidroksidi; eskirgan nomi kaustik soda, texnik nomi kaustik soda (lotincha kaustikdan - kaustik, yonish); eng mustahkam asoslaridan biri.
Texnik mahsulot, NaOH dan tashqari, aralashmalarni (3% gacha Na2CO3 va 1,5% NaCl) o'z ichiga oladi. NaOH ning katta miqdori gidroksidi batareyalar uchun elektrolitlar tayyorlash, qog'oz, sovun, bo'yoq, tsellyuloza ishlab chiqarish uchun ishlatiladi va neft va moylarni tozalash uchun ishlatiladi.
Natriy tuzlari orasida Na2CrO4 xromati - bo'yoqlar ishlab chiqarishda, matolarni bo'yash uchun mordan sifatida va charm sanoatida ko'nchilik vositasi sifatida ishlatiladi; sulfit Na2SO3 - fotografiyada fiksatorlar va ishlab chiquvchilarning tarkibiy qismi; gidrosulfit NaHSO3 - meva, sabzavotlar va o'simlik ozuqalarini saqlash uchun ishlatiladigan matolar va tabiiy tolalar uchun oqartiruvchi vosita; tiosulfat Na2S2O3 - matolarni oqartirishda xlorni olib tashlash uchun, fotosuratda fiksator sifatida, simob birikmalari, mishyak va boshqa yallig'lanishga qarshi vositalar bilan zaharlanish uchun antidot; xlorat NaClO3 - turli xil pirotexnika tarkibidagi oksidlovchi vosita; trifosfat Na5P3O10 - sintetik qo'shimcha Yuvish vositalari suvni yumshatish uchun. Natriy, NaOH va uning eritmalari teri va shilliq pardalarning qattiq kuyishiga olib keladi.
Kaliy. tomonidan ko'rinish va kaliyning xossalari natriyga o'xshaydi, lekin ko'proq reaktivdir.Suv bilan kuchli reaksiyaga kirishadi va vodorodning yonishiga sabab bo'ladi.
U havoda yonib, to'q sariq rangli superoksid CO2 hosil qiladi. Xona haroratida u halogenlar bilan, o'rtacha isitish bilan - vodorod va oltingugurt bilan reaksiyaga kirishadi. Nam havoda u tezda KOH qatlami bilan qoplanadi. Kaliyni benzin yoki kerosin qatlami ostida saqlang. amaliy foydalanish kaliy birikmalarini toping - KOH gidroksid, KNO3 nitrat va K2CO3 karbonat. Kaliy gidroksid KOH (texnik nomi - o'yuvchi kaliy) - nam havoda tarqaladigan va karbonat angidridni o'zlashtiradigan oq kristallar (K2CO3 va KHCO3 hosil bo'ladi). Yuqori ekzo effektli suvda juda eriydi. Suvli eritma juda ishqoriydir.
Kaliy gidroksid KCl eritmasini elektroliz qilish natijasida hosil bo'ladi (NaOH ishlab chiqarishga o'xshash). Asl kaliy xlorid KCl tabiiy xom ashyolardan (minerallar silvit KCl va karnallit KMgC13 6H20) olinadi. KOH turli xil kaliy tuzlari, suyuq sovun, bo'yoqlar sintezi uchun, akkumulyatorlarda elektrolit sifatida ishlatiladi.Kaliy nitrat KNO3 (mineral kaliy nitrat) - oq kristall, ta'mi juda achchiq, erish nuqtasi past (tm = 339 ° C). Suvda yaxshi eriydi (gidrolizsiz). Erish nuqtasidan yuqori qizdirilganda u kuchli oksidlovchi xususiyatga ega bo'lgan kaliy nitriti KNO2 va kislorod O2 ga parchalanadi.
Oltingugurt va ko'mir erigan KNO3 bilan aloqa qilganda yonadi va C + S aralashmasi portlaydi («qora kukun» yonishi): 2KNO3 + ZS (ko'mir) + S=N2 + 3CO2 + K2S Kaliy nitrat shisha va mineral o'g'itlar ishlab chiqarishda ishlatiladi.
Kaliy karbonat K2CO3 (texnik nomi - kaliy) oq gigroskopik kukundir. Suvda juda yaxshi eriydi, anionda kuchli gidrolizlanadi va eritmada ishqoriy muhit hosil qiladi.Shisha va sovun ishlab chiqarishda ishlatiladi. K2CO3 ishlab chiqarish quyidagi reaksiyalarga asoslanadi: K2SO4 + Ca(OH)2 + 2CO = 2K(HCOO) + CaSO4 2K(HCOO) + O2 = K2C03 + H20 + CO2 Tabiiy xom ashyodan kaliy sulfat (minerallar kainit KMg(SO4)) )Cl ZH20 va sxonit K2Mg(SO4)2 * 6H20) so‘ndirilgan ohak Ca(OH)2 bilan CO atmosferasida (15 atm bosim ostida) isitiladi, kaliy formati K(HCOO) olinadi, u kalsiylanadi. havo oqimi.
Kaliy hayotiy ahamiyatga ega muhim element o'simliklar va hayvonlar uchun. Kaliyli o'g'itlar - kaliy tuzlari, ham tabiiy, ham ularning qayta ishlangan mahsulotlari (KCl, K2SO4, KNO3); o'simlik kulida kaliy tuzlari ko'p.Kaliy yer qobig'ida to'qqizinchi o'rinda turadi. Minerallarda, dengiz suvida (1 litrda 0,38 g K+ ionlarigacha), o'simliklarda va tirik organizmlarda (hujayra ichida) faqat bog'langan holda mavjud. Inson tanasida = 175 g kaliy mavjud, kunlik ehtiyoj ~ 4 g ga etadi. 40K radioaktiv izotopi (asosiy barqaror izotop 39K aralashmasi) juda sekin parchalanadi (yarimparchalanish davri 1109 yil), u 238U va 232Th izotoplari bilan birgalikda sayyoramizning geotermal zaxirasiga katta hissa qo'shadi (ichki issiqlik) Yerning ichki qismi). Mis. From (lot. Cuprum), Cu, davriy tizimning 16 kichik guruhining kimyoviy elementi; atom raqami 29, atom massasi 63,546 o'tish metallariga tegishli. Tabiiy mis massa soni 63 (69,1%) va 65 (30,9%) bo'lgan nuklidlar aralashmasidir. Tabiatda tarqalishi.
Yer qobig'idagi misning o'rtacha miqdori massa bo'yicha 4,7-10 ~ 3% ni tashkil qiladi.
Yer qobig'ida mis nuggetlar shaklida ham, turli xil minerallar shaklida ham uchraydi.Ba'zan sezilarli darajada bo'lgan mis nuggetlari yashil yoki ko'k rangli qoplama bilan qoplangan va toshga nisbatan g'ayrioddiy og'irdir; Og'irligi taxminan 420 tonna bo'lgan eng katta nugget AQShda Buyuk ko'llar mintaqasida topilgan (rasm). Misning katta qismi tog' jinslarida birikmalar shaklida mavjud.
Misni o'z ichiga olgan 250 dan ortiq minerallar ma'lum. Sanoat ahamiyatiga ega: xalkopirit (mis pirit) CuFeS2, kovellit (mis indigo) Cu2S, xalkotsit (mis yaltirashi) Cu2S, kuprit Cu2O, malaxit CuCO3*Cu(OH)2 va azurit 2CuCO3*Cu(OH)2. Deyarli barcha mis minerallari yorqin va chiroyli rangga ega, masalan, xalkopirit oltin yaltiroq, mis yaltiroq poʻlat-koʻk rangga ega, azurit shishasimon yaltiroq toʻq koʻk rangga ega, kovellit parchalari kamalakning barcha ranglarida porlaydi. .
Ko'pgina mis minerallari bezak va qimmatbaho toshlar- qimmatbaho toshlar; Malaxit va turkuaz CuA16(PO4)4(OH)8*5H2O juda yuqori baholanadi. Mis rudalarining eng yirik konlari Shimoliy va Janubiy Amerika(AQSh, Kanada, Chili, Peru, Meksika), Afrika (Zambiya, Janubiy Afrika), Osiyo (Eron, Filippin, Yaponiyadagi asosiy namuna). Rossiyada Ural va Oltoyda mis rudalari konlari mavjud. Mis rudalari odatda polimetalldir: misdan tashqari ular tarkibida Fe, Zn, Pb, Sn, Ni, Mo, Au, Ag, Se, platina metallari va boshqalar mavjud. Tarixiy ma'lumotlar.
Mis qadim zamonlardan beri ma'lum bo'lib, insoniyat tomonidan ishlatiladigan eng qadimgi metallarning "ajoyib yettiligi" dan biri: oltin, kumush, mis, temir, qalay, qo'rg'oshin va simob. Arxeologik ma'lumotlarga ko'ra, mis odamlarga 6000 yil oldin ma'lum bo'lgan. Bu almashtiriladigan birinchi metall bo'lib chiqdi qadimgi odam ibtidoiy mehnat qurollaridagi tosh.Bu atalmishning boshlanishi edi. taxminan ikki ming yil davom etgan mis davri.
Misdan bolta, pichoq, toʻr, uy-roʻzgʻor buyumlari yasalib, soʻngra eritilgan. Afsonaga ko'ra, qadimgi temirchi xudo Gefest yengilmas Axilles uchun sof misdan qalqon yasagan. Xeopsning 147 metrli piramidasi uchun toshlar ham qazib olingan va mis asboblar bilan yoyilgan.Qadimgi rimliklar mis rudasini Kipr orolidan eksport qilgan, shuning uchun misning lotincha nomi - “cuprum”. Ruscha "mis" nomi "smida" so'zi bilan bog'liq bo'lib, qadimgi davrlarda "metall" degan ma'noni anglatadi. Sinay yarim orolida qazib olingan rudalarda ba'zan qalay aralashmasi mavjud bo'lib, bu mis va qalay qotishmasi - bronza kashf qilinishiga olib keldi.
Bronza misning o'ziga qaraganda ancha eruvchan va qattiqroq bo'lib chiqdi. Bronzaning topilishi uzoq bronza davrining (miloddan avvalgi 4—1-ming yilliklar) boshlanishini belgilab berdi. Xususiyatlari. Mis qizil metalldir M.P. 1083 "C, qaynash harorati 2567 °C, zichligi 8,92 g/sm. Bu egiluvchan, egiluvchan metalldir; barglari qog'oz qog'ozga qaraganda 5 barobar yupqaroq bo'lishi mumkin.
Mis yorug'likni yaxshi aks ettiradi va issiqlik va elektr tokini yaxshi o'tkazadi, kumushdan keyin ikkinchi o'rinda turadi. 3d104s1 mis atomining tashqi elektron qatlamlarining konfiguratsiyasi (d-element). Mis va ishqoriy metallar bir I guruhga kirsa ham, ularning xulq-atvori va xossalari juda farq qiladi.Mis ishqoriy metallarga faqat bir valentli kationlar hosil qilish qobiliyati bilan o'xshaydi. Birikmalar hosil qilganda, mis atomi nafaqat tashqi s-elektronini, balki oldingi qatlamning bir yoki ikkita d-elektronini yo'qotishi mumkin, shu bilan birga ko'proq namoyon bo'ladi. yuqori daraja oksidlanish.
Mis uchun oksidlanish darajasi +2 +1 dan ko'proq xosdir. Metall mis quruq va toza havoda past faol va barqaror. Tarkibida CO2 boʻlgan nam havoda uning yuzasida patina deb ataladigan yashil rangli Cu(OH)2*CuCO3 plyonkasi hosil boʻladi. Patina mis va uning qotishmalaridan tayyorlangan mahsulotlarga chiroyli "antik" ko'rinish beradi; patinaning uzluksiz qoplamasi, qo'shimcha ravishda, metallni keyingi yo'q qilishdan himoya qiladi.Mis toza va quruq kislorodda qizdirilganda, qora oksid CuO hosil bo'ladi; 375 ° C dan yuqori qizdirish qizil oksidi Cu2O hosil qiladi. Oddiy haroratlarda mis oksidlari havoda barqaror bo'ladi. Ketma-ket kuchlanishda mis vodorodning o'ng tomonida joylashgan va shuning uchun u vodorodni suvdan siqib chiqarmaydi va kislorodsiz kislotalarda ham bo'lmaydi. Mis bir vaqtning o'zida oksidlanganda kislotalarda, masalan, nitrat kislota yoki konsentrlangan sulfat kislotada erishi mumkin: 3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O Cu + 2H2S04 = CuSO4 + SO2 + 2H2O Flor, brox va reakt. mis bilan , mos keladigan digalidlarni hosil qiladi, masalan: Cu + Cl2 = CuCl2 qizdirilgan mis kukuni yod bilan o'zaro ta'sirlashganda Cu(I) yodid olinadi yoki mis monoiodid: 2Cu + I2 = 2CuI Mis oltingugurt bug'ida yonib, CuS monosulfidi hosil qiladi. . Oddiy sharoitlarda vodorod bilan o'zaro ta'sir qilmaydi.
Biroq, agar mis namunalarida Cu2O oksidining mikroifratlari bo'lsa, u holda vodorod, metan yoki uglerod oksidi bo'lgan atmosferada mis oksidi metallga qaytariladi: Cu2O+ H2 = 2Cu + H2O Cu2O+ CO = 2Cu + CO2 Chiqarilgan suv bug'lari va CO2 yoriqlar hosil qiladi. paydo bo'lishi, bu metallning mexanik xususiyatlarini keskin yomonlashtiradi ("vodorod kasalligi"). Monivalent mis tuzlari - CuCl xlorid, Cu2SO3 sulfit, Cu2S sulfid va boshqalar - qoida tariqasida suvda yomon eriydi. Ikki valentli mis uchun deyarli barcha ma'lum kislotalarning tuzlari mavjud; ularning eng muhimlari CuSO4 sulfat, CuCl2 xlorid, Cu(NO3)2 nitrat.Ularning barchasi suvda yaxshi eriydi va undan ajratib olinganda kristall gidratlar hosil qiladi, masalan CuCl2*2H2O, Cu(NO3)2*. 6H2O, Cu8O4-5H20. Tuzlarning rangi yashildan koʻk ranggacha boʻladi, chunki suvdagi Cu ioni gidratlangan boʻlib, ikki valentli mis tuzlari eritmalarining rangini aniqlaydigan koʻk rangli akvaion [Cu(H2O)6]2+ shaklida boʻladi. Eng muhim mis tuzlaridan biri - sulfat metallni qizdirilgan suyultirilgan sulfat kislotada havo puflaganda eritib olinadi: 2Su + 2N2SO4 + O2 = 2SuSO4 + 2N2O Suvsiz sulfat rangsiz; suv qo'shib, u mis sulfat CuSO4-5H2O - azur-ko'k shaffof kristallarga aylanadi.
Mis sulfat namlanganda rangini o'zgartirish xususiyati tufayli spirt, efir, benzin va boshqalardagi suv izlarini aniqlash uchun ishlatiladi. Ikki valentli mis tuzi ishqor bilan o'zaro ta'sirlashganda, katta hajmli ko'k cho'kma hosil bo'ladi - Cu(OH)2 gidroksid. U amfoterdir: konsentrlangan ishqorda eriydi va anion holida mis boʻlgan tuz hosil qiladi, masalan: Cu(OH)2 + 2KOH = K2[Cu(OH)4] Ishqoriy metallardan farqli oʻlaroq mis. komplekslar hosil qilish tendentsiyasi bilan tavsiflanadi - suvdagi Cu va Cu2+ ionlari anionlar (Cl CN-), neytral molekulalar (NH3) va ba'zi organik birikmalar bilan murakkab ionlar hosil qilishi mumkin.
Bu komplekslar odatda yorqin rangga ega va suvda yaxshi eriydi. Kvitansiya va ariza.
19-asrda. mis kamida 15% metallni o'z ichiga olgan rudalardan eritilgan.
Hozirgi vaqtda boy mis rudalari amalda tugaydi, shuning uchun mis ch. arr. tarkibida atigi 1-7% mis boʻlgan sulfidli rudalardan olinadi. Metall eritish uzoq va ko'p bosqichli jarayondir. Dastlabki rudani flotatsion ishlovdan o'tkazgandan so'ng, temir va mis sulfidlarini o'z ichiga olgan konsentrat 1200 ° C ga qadar isitiladigan mis eritish pechlariga joylashtiriladi. Konsentrat eriydi, deb atalmish hosil qiladi. eritilgan mis, temir va oltingugurtni o'z ichiga olgan mat, shuningdek, sirtga suzuvchi qattiq silikat cüruflari.
CuS shaklidagi eritilgan mat tarkibida taxminan 30% mis, qolgan qismi temir sulfid va oltingugurtdan iborat. Keyingi bosqich - matni deb atalmish narsaga aylantirish. blister mis, bu kislorod bilan tozalangan gorizontal konvertorli pechlarda amalga oshiriladi.
FeS avval oksidlanadi; Olingan temir oksidini bog'lash uchun konvertorga kvarts qo'shiladi - bu oson ajratilgan silikat cürufini hosil qiladi. Keyin CuS oksidlanib, metall misga aylanadi va SO2 ajralib chiqadi: CuS + O2 = Cu + SO2 SO2 ni havo bilan olib tashlangandan so'ng, konvertorda 97-99% mis bo'lgan qolgan blister mis qoliplarga quyiladi va keyin ta'sirlanadi. elektrolitik tozalash uchun.
Buning uchun qalin taxtalarga o'xshash blister mis ingotlari H2SO4 qo'shilgan mis sulfat eritmasi bo'lgan elektroliz vannalarida to'xtatiladi. Xuddi shu vannalarda sof misning yupqa choyshablari ham to'xtatiladi. Ular katod bo'lib xizmat qiladi va blister mis quymalari anod sifatida xizmat qiladi. Oqim o'tishida mis anodda eriydi va uning ajralib chiqishi katodda sodir bo'ladi: Cu - 2e = Cu2+ Cu2+ + 2e = Cu Nopokliklar, shu jumladan kumush, oltin, platina vannaning tubiga quyidagi shaklda tushadi. loyga o'xshash massa (loy). Qimmatbaho metallarni loydan olish, odatda, butun energiya talab qiladigan jarayonni to'laydi.
Bunday tozalashdan so'ng, hosil bo'lgan metall 98-99% misni o'z ichiga oladi. Mis uzoq vaqtdan beri qurilishda ishlatilgan: qadimgi misrliklar mis suv quvurlarini qurishgan; O'rta asr qal'alari va cherkovlarining tomlari mis choyshab bilan qoplangan, masalan, Elsinoredagi (Daniya) mashhur qirol qal'asi mis tom bilan qoplangan.
Misdan tangalar va zargarlik buyumlari yasalgan.
Kam elektr qarshiligi tufayli mis elektrotexnikada asosiy metall hisoblanadi: ishlab chiqarilgan barcha misning yarmidan ko'pi yuqori kuchlanishli uzatish va past oqim kabellari uchun elektr simlarini ishlab chiqarishda ishlatiladi. Mis tarkibidagi arzimas aralashmalar ham uning elektr qarshiligining oshishiga va elektr energiyasining katta yo'qotilishiga olib keladi.Yuqori issiqlik o'tkazuvchanligi va korroziyaga chidamliligi mis qismlaridan issiqlik almashtirgichlar, muzlatgichlar, vakuum qurilmalari, moy va yoqilg'i quyish uchun quvurlar va boshqalarni ishlab chiqarishga imkon beradi. Po'lat buyumlar uchun himoya qoplamalar qo'llanilganda mis elektrokaplamada ham keng qo'llaniladi.
Shunday qilib, masalan, po'lat buyumlarni nikel yoki xrom bilan qoplashda ularga mis oldindan yotqiziladi; bu holda himoya qoplamasi uzoqroq davom etadi va samaraliroq bo'ladi. Mis, shuningdek, elektrokaplamada (ya'ni, ko'zgu tasvirini olish orqali mahsulotlarni takrorlashda), masalan, banknotlarni chop etish va haykaltaroshlik mahsulotlarini qayta ishlab chiqarish uchun metall matritsalar ishlab chiqarishda ham qo'llaniladi.
Misning katta qismi ko'plab metallar bilan hosil bo'lgan qotishmalarni ishlab chiqarishga sarflanadi. Misning asosiy qotishmalari odatda uch guruhga bo'linadi: bronzalar (rux va nikeldan tashqari qalay va boshqa metallar bilan qotishmalar), guruchlar (rux bilan qotishmalar) va mis-nikel qotishmalari. Ensiklopediyada bronza va jez haqida alohida maqolalar berilgan.Eng mashhur mis-nikel qotishmalari kupronikel, nikel kumush, konstantan, manganin; ularning barchasida 30-40% gacha nikel va har xil qotishma qo'shimchalar mavjud.
Ushbu qotishmalar kemasozlikda, yuqori haroratlarda ishlaydigan qismlarni ishlab chiqarishda, elektr qurilmalarda, shuningdek kumush (vilkalar pichoq) o'rniga maishiy metall buyumlar uchun ishlatiladi. Mis birikmalari turli xil ilovalarda mavjud va topilgan. Kup oksidi va sulfat ma'lum turdagi sun'iy tolalarni ishlab chiqarish va boshqa mis birikmalarini ishlab chiqarish uchun ishlatiladi; CuO va Cu2O shisha va emal ishlab chiqarish uchun ishlatiladi; Su(NO3)2 - kaliko bosib chiqarish; CuCl2 - mineral bo'yoqlarning tarkibiy qismi, katalizator.
Misni o'z ichiga olgan mineral bo'yoqlar qadim zamonlardan beri ma'lum; Shunday qilib, Pompeyning qadimiy freskalari va Rossiyadagi devor rasmlari tahlili shuni ko'rsatdiki, bo'yoqlar tarkibida asosiy mis asetat Cu(OH)2*(CH3COO)2Cu2 mavjud bo'lib, u yorqin yashil bo'yoq vazifasini o'taydi, u Vergris deb ataladi. Rossiya.Mis atalmishlarga tegishli. o'simliklar va hayvonlarning normal rivojlanishi uchun zarur bo'lgan bioelementlar.
O'simlik to'qimalarida misning etishmasligi yoki etishmasligi bilan xlorofill miqdori kamayadi, barglar sarg'ayadi, o'simliklar meva berishni to'xtatadi va o'lishi mumkin. Shuning uchun mis o'g'itlari tarkibiga ko'plab mis tuzlari kiradi, masalan, mis sulfat, mis-kaliyli o'g'itlar (KSD bilan aralashtirilgan mis sulfat). Mis tuzlari o'simlik kasalliklariga qarshi kurashda ham qo'llaniladi.Yuz yildan ortiq vaqt davomida buning uchun asosiy mis sulfat [Cu(OH)2]3CuSO4 bo'lgan Bordo aralashmasi ishlatilgan; reaksiya orqali olinadi: 4CuSO4 + 3Ca(OH)2 = CuSO4 *3Cu(OH)2 + 3CaSO4 Bu tuzning jelatinli choʻkmasi barglarni yaxshi qoplaydi va ularda uzoq vaqt saqlanib, oʻsimlikni himoya qiladi.
Cu2O, mis xloroksid 3Cu(OH)2*CuCl2, shuningdek, mis fosfat, borat va mis arsenat ham xuddi shunday xususiyatga ega. Inson tanasida mis ba'zi fermentlarning bir qismi bo'lib, gematopoez va fermentativ oksidlanish jarayonlarida ishtirok etadi; Inson qonidagi o'rtacha mis miqdori taxminan 0,001 mg / l ni tashkil qiladi. Pastki hayvonlar organizmlarida mis ancha ko'p, masalan, gemosiyanin - mollyuskalar va qisqichbaqasimonlarning qon pigmenti - 0,26% gacha misni o'z ichiga oladi. Tirik organizmlardagi misning o'rtacha miqdori og'irlik bo'yicha 2-10-4% ni tashkil qiladi.
Odamlar uchun mis birikmalari asosan zaharli hisoblanadi. Mis ayrim farmatsevtika vositalarining bir qismi bo‘lishiga qaramay, agar u ko‘p miqdorda suv yoki oziq-ovqat bilan oshqozonga tushsa, og‘ir zaharlanishga olib kelishi mumkin.Mis va uning qotishmalarini eritishda uzoq vaqt ishlaydigan odamlarda ko‘pincha “mis isitmasi” rivojlanadi. ” - harorat ko'tariladi, oshqozon hududida og'riq paydo bo'ladi va o'pkaning hayotiy faoliyati kamayadi. Mis tuzlari oshqozonga tushsa, shifokor kelishidan oldin uni shoshilinch yuvish va diuretik qabul qilish kerak.
Xulosa. Metalllar mashinasozlik va asbobsozlikda asosiy konstruktiv material boʻlib xizmat qiladi.Ularning barchasi umumiy deb ataluvchi metall xossalariga ega, lekin har bir element ularni D.I.Mendeleyev davriy sistemasidagi oʻz oʻrniga mos ravishda, yaʼni tuzilish xususiyatlariga koʻra namoyon qiladi. uning atomi.
Metalllar yuqori elektr manfiyli elementar oksidlovchi moddalar (galogenlar, kislorod, oltingugurt va boshqalar) bilan faol ta'sir o'tkazadi va shuning uchun metall elementlarning umumiy xususiyatlarini ko'rib chiqishda ularning metall bo'lmaganlarga nisbatan kimyoviy faolligini, ularning turlarini hisobga olish kerak. ularning birikmalari va kimyoviy bog'lanish shakllari, chunki bu nafaqat ularni ishlab chiqarish jarayonida metallurgiya jarayonlarini, balki ish sharoitida metallarning ishlashini ham belgilaydi.
Iqtisodiyot jadal sur’atlar bilan rivojlanayotgan bugungi kunda katta kapital qo‘yilmalarni talab qilmaydigan yig‘ma binolarga ehtiyoj sezilmoqda. Bu, asosan, savdo pavilyonlari, ko‘ngilochar markazlar, omborlar qurish uchun zarurdir.Metal konstruksiyalardan foydalangan holda bunday binolarni endi nafaqat oson va tez o‘rnatish, balki ijara muddati tugashi bilan bir xil osonlik bilan demontaj qilish mumkin. boshqa joyga ko'chish. Bundan tashqari, bunday oson qurilgan binolarga kommunikatsiyalar, isitish va yorug'lik o'rnatish qiyin emas. Metall konstruksiyalardan qurilgan binolar nafaqat harorat sharoitlari nuqtai nazaridan, balki g'ishtli binolarni qurish oson yoki xavfsiz bo'lmagan seysmologik faollik nuqtai nazaridan ham bir xil darajada muhim bo'lgan og'ir tabiiy sharoitlarga bardosh bera oladi.
Bugungi kunda sanoat tomonidan taklif etilayotgan metall konstruksiyalarning assortimenti osongina ko'chiriladi va har qanday kranlar tomonidan ko'tarilishi mumkin. Bunday tuzilmalarni ulash va o'rnatish murvat yoki payvandlash yordamida amalga oshirilishi mumkin.
Integratsiyalashgan holda ishlab chiqariladigan va etkazib beriladigan engil metall konstruksiyalarning paydo bo'lishi jamoat binolarini qurishda temir-betondan yasalgan binolarni qurish bilan solishtirganda katta ijobiy rol o'ynaydi va ishlarni bajarish uchun zarur bo'lgan vaqtni sezilarli darajada qisqartiradi. Foydalanilgan adabiyotlar ro'yxati. 1. Xomchenko G.P. Universitetlarga abituriyentlar uchun kimyo bo'yicha qo'llanma. - 3-nashr - M.: "Novaya Volna" nashriyoti MChJ, "ONIKS" nashriyot uyi YoAJ, 1999 464 b. 2. A.S.Egorova.
Kimyo. Universitetlarga abituriyentlar uchun qo'llanma - 2-nashr - Rostov N/D: Feniks nashriyoti, 1999. - 768 p. 3. Frolov V.V. Kimyo: Mashinasozlik maxsus universitetlari uchun darslik. – 3-nashr qayta koʻrib chiqilgan. va qo'shimcha - M.: magistratura, 1986 543 bet. 4. Lidin R.A. Kimyo. O'rta maktab o'quvchilari va oliy o'quv yurtlariga kiruvchilar uchun: Nazariy asos. Savollar. Vazifalar.Testlar: Darslik. Qo'llanma/2-nashr stereotipi. – M.: Bustard, 2002. – 576 b. 5. Yu.A.Zolotov.
Kimyo. Maktab ensiklopediyasi.M.: - Bustard, “Katta Rus ensiklopediyasi» 2003. – 872 b.
Qabul qilingan material bilan nima qilamiz:
Agar ushbu material siz uchun foydali bo'lsa, uni ijtimoiy tarmoqlardagi sahifangizga saqlashingiz mumkin:
Metalllarni tashkil qiladi eng kimyoviy elementlar. Kimyoviy elementlarning davriy jadvalining har bir davri (1-chidan tashqari) metallardan boshlanadi va davr sonining ko'payishi bilan ularning soni ko'payadi. Agar 2-davrda faqat 2 ta metall (litiy va berilliy), 3-da - 3 (natriy, magniy, alyuminiy) bo'lsa, u holda allaqachon 4-da - 13 va 7-da - 29.
Metall atomlari tashqi elektron qatlamining tuzilishida o'xshash bo'lib, u oz sonli elektronlar tomonidan hosil bo'ladi (odatda uchtadan ko'p emas).
Bu bayonotni Na, alyuminiy A1 va sink Zn misollari bilan tasvirlash mumkin. Atomlar tuzilishining diagrammalarini tuzishda siz ixtiyoriy ravishda elektron formulalar yaratishingiz va uzoq davrlar elementlarining tuzilishiga misollar keltirishingiz mumkin, masalan, sink.
Metall atomlarining tashqi qatlamining elektronlari yadro bilan zaif bog'langanligi sababli, ular boshqa zarrachalarga "berilishi" mumkin, bu kimyoviy reaktsiyalarda sodir bo'ladi:
![]()
Metall atomlarining elektronlardan voz kechish xususiyati ularning xarakterli kimyoviy xossasi bo'lib, metallarning qaytaruvchi xususiyatga ega ekanligini ko'rsatadi.
Metalllarning fizik xususiyatlarini tavsiflashda ularni ta'kidlash kerak umumiy xususiyatlar: elektr o'tkazuvchanligi, issiqlik o'tkazuvchanligi, metall yorqinligi, plastiklik, ular kimyoviy bog'lanishning yagona turi - metall va metall kristall panjara bilan belgilanadi. Ularning xususiyati kristall panjara tugunlarida joylashgan ion-atomlar orasida erkin harakatlanuvchi ijtimoiylashgan elektronlarning mavjudligidir.
Kimyoviy xossalarni xarakterlashda barcha reaksiyalarda metallar qaytaruvchi xossalarini namoyon qiladi degan xulosani tasdiqlash va buni reaksiya tenglamalarini yozish orqali ko‘rsatish zarur. Maxsus e'tibor metallarning kislotalar va tuz eritmalari bilan o'zaro ta'siriga e'tibor berish kerak va bir qator metall kuchlanishlarga (bir qator standart elektrod potentsiallariga) murojaat qilish kerak.
Metalllarning oddiy moddalar (metall bo'lmaganlar) bilan o'zaro ta'siriga misollar:

Tuzlar bilan (kuchlanish seriyasidagi Zn Cu ning chap tomonida): Zn + CuC12 = ZnCl2 + Cu!
Shunday qilib, metallarning xilma-xilligiga qaramay, ularning barchasi umumiy jismoniy va xususiyatlarga ega kimyoviy xossalari, bu atomlar tuzilishi va oddiy moddalar tuzilishidagi o'xshashlik bilan izohlanadi.
Kirish
Metalllar oddiy sharoitda xarakterli xususiyatlarga ega bo'lgan oddiy moddalardir: yuqori elektr va issiqlik o'tkazuvchanligi, yorug'likni yaxshi aks ettirish qobiliyati (bu ularning porlashi va shaffofligini keltirib chiqaradi) va tashqi kuchlar ta'sirida kerakli shaklni olish qobiliyati ( plastiklik). Metalllarning yana bir ta'rifi mavjud - bu tashqi (valentlik) elektronlarni berish qobiliyati bilan tavsiflangan kimyoviy elementlar.
Barcha ma'lum kimyoviy elementlarning 90 ga yaqini metallardir. Aksariyat noorganik birikmalar metall birikmalaridir.
Metalllarni tasniflashning bir necha turlari mavjud. Eng aniq metallarning kimyoviy elementlarning davriy tizimidagi o'z o'rniga ko'ra tasnifi - kimyoviy tasnif.
Agar davriy jadvalning "uzun" versiyasida biz bor va astatin elementlari orqali to'g'ri chiziq chizadigan bo'lsak, u holda metallar bu chiziqning chap tomonida, metall bo'lmaganlar esa uning o'ng tomonida joylashgan bo'ladi.
Atom tuzilishi nuqtai nazaridan metallar o'tish va o'tishga bo'linadi. O'tishga to'g'ri kelmaydigan metallar davriy tizimning asosiy kichik guruhlarida joylashgan bo'lib, ularning atomlarida s va p elektron darajalari ketma-ket to'ldirilganligi bilan tavsiflanadi. O‘tish o‘tkazmaydigan metallar a asosiy kichik guruhlarning 22 ta elementini o‘z ichiga oladi: Li, Na, K, Rb, Cs, Fr, Be, Mg, Ca, Sr, Ba, Ra, Al, Ga, In, Tl, Ge, Sn, Pb. , Sb, Bi, Po.
O'tish metallari ikkilamchi kichik guruhlarda joylashgan bo'lib, d- yoki f-elektron darajalarini to'ldirish bilan tavsiflanadi. d-elementlarga ikkilamchi kichik guruh b ning 37 ta metallari kiradi: Cu, Ag, Au, Zn, Cd, Hg, Sc, Y, La, Ac, Ti, Zr, Hf, Rf, V, Nb, Ta, Db, Cr, Mo , W, Sg, Mn, Tc, Re, Bh, Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Pt, Hs, Mt.
f-elementlarga 14 ta lantanid (Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Du, Ho, Er, Tm, Yb, Lu) va 14 aktinid (Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, Yo'q, Lr).
Oʻtish metallari orasida nodir tuproq metallari (Sc, Y, La va lantanidlar), platina metallari (Ru, Rh, Pd, Os, Ir, Pt), transuran metallari (Np va atom massasi yuqori boʻlgan elementlar) ham ajralib turadi.
Kimyoviydan tashqari, umumiy qabul qilinmasa ham, metallarning uzoq vaqtdan beri tasdiqlangan texnik tasnifi mavjud. Bu kimyoviy kabi mantiqiy emas - u metallning u yoki bu amaliy muhim xususiyatiga asoslanadi. Temir va uning asosidagi qotishmalar qora metallar, qolgan barcha metallar esa rangli metallar deb tasniflanadi. Yengil (Li, Be, Mg, Ti va boshqalar) va og'ir metallar (Mn, Fe, Co, Ni, Cu, Zn, Cd, Hg, Sn, Pb va boshqalar), shuningdek, o'tga chidamli metallar guruhlari mavjud. (Ti, Zr , Hf, V, Nb, Ta, Cr, Mo, W, Re), qimmatbaho (Ag, Au, platina metallari) va radioaktiv (U, Th, Np, Pu va boshqalar) metallar. Geokimyoda iz (Ga, Ge, Hf, Re va boshqalar) va noyob (Zr, Hf, Nb, Ta, Mo, W, Re va boshqalar) metallar ham farqlanadi. Ko'rib turganingizdek, guruhlar o'rtasida aniq chegaralar yo'q.
Tarixiy ma'lumotnoma
Insoniyat jamiyatining metallarsiz hayoti mumkin emasligiga qaramay, odamlar ularni qachon va qanday qilib birinchi marta ishlata boshlaganini hech kim aniq bilmaydi. Bizgacha yetib kelgan eng qadimiy yozuvlarda metall eritilgan va undan mahsulotlar tayyorlangan ibtidoiy ustaxonalar haqida hikoya qilinadi. Bu shuni anglatadiki, inson yozishdan oldin metallarni o'zlashtirgan. Qadimgi aholi punktlarini qazishda arxeologlar o'sha uzoq davrlarda odamlar ishlatgan mehnat va ov qurollari - pichoqlar, boltalar, o'q uchlari, ignalar, baliq ilgaklari va boshqalarni topadilar. Aholi punktlari qanchalik qadimgi bo'lsa, inson qo'li bilan yaratilgan mahsulotlar shunchalik qo'pol va ibtidoiy edi. Eng qadimgi metall buyumlar taxminan 8 ming yil oldin mavjud bo'lgan aholi punktlarini qazish paytida topilgan. Bular, asosan, oltin va kumushdan yasalgan taqinchoqlar hamda misdan yasalgan oʻq uchlari va nayzalar edi.
Yunoncha "metallon" so'zi dastlab minalar degan ma'noni anglatadi, shuning uchun "metall" atamasi. Qadimgi davrlarda faqat 7 ta metal borligiga ishonishgan: oltin, kumush, mis, qalay, qo'rg'oshin, temir va simob. Bu raqam o'sha paytda ma'lum bo'lgan sayyoralar soniga bog'liq edi - Quyosh (oltin), Oy (kumush), Venera (mis), Yupiter (qalay), Saturn (qo'rg'oshin), Mars (temir), Merkuriy (simob) ( rasmga qarang). Alkimyoviy g'oyalarga ko'ra, metallar sayyoralar nurlari ta'sirida erning ichaklarida paydo bo'lgan va asta-sekin yaxshilanib, oltinga aylangan.
Inson dastlab mahalliy metallarni - oltin, kumush, simobni o'zlashtirdi. Sun'iy ravishda ishlab chiqarilgan birinchi metall mis edi, keyin tungi - bronza va keyinroq - temir bilan mis qotishmasini ishlab chiqarishni o'zlashtirish mumkin edi. 1556 yilda Germaniyada nemis metallurgi G. Agrikolaning "Tog'-kon va metallurgiya to'g'risida" kitobi nashr etildi - bizgacha yetib kelgan metallarni olish bo'yicha birinchi batafsil qo'llanma. To'g'ri, o'sha paytda qo'rg'oshin, qalay va vismut hali ham bir xil metallning navlari hisoblanardi. 1789-yilda fransuz kimyogari A.Lavuazye o‘zining kimyo bo‘yicha qo‘llanmasida oddiy moddalar ro‘yxatini keltirgan bo‘lib, ular o‘sha paytda ma’lum bo‘lgan barcha metallar – surma, kumush, vismut, kobalt, qalay, temir, marganets, nikel, oltin, platinani o‘z ichiga olgan. , qo'rg'oshin, volfram va sink. Kimyoviy tadqiqot usullari rivojlangan sari, ma'lum bo'lgan metallar soni tez sur'atlar bilan ko'paya boshladi. 18-asrda 19-asrda 14 ta metallar topilgan. - 38, 20-asrda. - 25 ta metallar. 19-asrning birinchi yarmida. Platinaning sun'iy yo'ldoshlari topildi, elektroliz yo'li bilan gidroksidi va ishqoriy tuproq metallari olindi. Asr oʻrtalarida spektral tahlil yoʻli bilan seziy, rubidiy, talliy va indiy topildi. D.I.Mendeleyevning davriy qonuni asosida bashorat qilgan metallar mavjudligi (bular galiy, skandiy va germaniy) yorqin tarzda tasdiqlandi. 19-asr oxirida radioaktivlikning kashf etilishi. radioaktiv metallarni izlashga olib keldi. Nihoyat, 20-asrning o'rtalarida yadroviy transformatsiyalar usuli bilan. tabiatda mavjud bo'lmagan radioaktiv metallar, xususan, transuran elementlari olindi.
Metalllarning fizik va kimyoviy xossalari.
Barcha metallar qattiq moddalardir (normal sharoitda suyuq bo'lgan simobdan tashqari), ular metall bo'lmaganlardan maxsus turdagi bog'lanish (metall bog') bilan farqlanadi. Valentlik elektronlari ma'lum bir atomga zaif bog'langan va har bir metalning ichida elektron gaz deb ataladigan narsa mavjud. Ko'pgina metallar kristalli tuzilishga ega va metallni musbat ionlarning (kationlarning) "qattiq" kristall panjarasi deb hisoblash mumkin. Ushbu elektronlar metall atrofida ko'proq yoki kamroq harakatlanishi mumkin. Ular kationlar orasidagi itaruvchi kuchlarni qoplaydi va shu bilan ularni ixcham jismga bog'laydi.
Barcha metallar elektr o'tkazuvchanligi yuqori (ya'ni, ular dielektrik bo'lgan metall bo'lmagan metallardan farqli o'laroq o'tkazgichlardir), ayniqsa mis, kumush, oltin, simob va alyuminiy; Metalllarning issiqlik o'tkazuvchanligi ham yuqori. Ko'pgina metallarning o'ziga xos xususiyati ularning egiluvchanligi (egiluvchanligi) bo'lib, buning natijasida ular yupqa qatlamlarga (folga) o'ralishi va simga (qalay, alyuminiy va boshqalar) tortilishi mumkin, ammo juda mo'rt metallar ham mavjud ( rux, surma, vismut).
Sanoatda ular ko'pincha sof metallardan emas, balki qotishmalar deb ataladigan aralashmalardan foydalanadilar. Qotishmada bir komponentning xususiyatlari odatda ikkinchisining xususiyatlarini muvaffaqiyatli to'ldiradi. Shunday qilib, mis past qattiqlikka ega va mashina qismlarini ishlab chiqarish uchun yaroqsiz, guruch deb ataladigan mis va sink qotishmalari allaqachon juda qattiq va mashinasozlikda keng qo'llaniladi. Alyuminiy yaxshi egiluvchanlik va etarlicha yengillikka ega (past zichlik), lekin juda yumshoq. Uning asosida mis, magniy va marganetsni o'z ichiga olgan ayuralum (duralumin) qotishmasi tayyorlanadi. Duralumin o'zining alyuminiy xususiyatlarini yo'qotmasdan, yuqori qattiqlikka ega bo'ladi va shuning uchun samolyot texnologiyasida qo'llaniladi. Temirning uglerodli qotishmalari (va boshqa metallarning qo'shimchalari) taniqli quyma temir va po'latdir.
Metalllarning zichligi juda katta farq qiladi: litiy uchun u suvning deyarli yarmi (0,53 g / sm3), osmiy uchun esa 20 barobardan ortiq (22,61 g / sm3). Metalllar qattiqligida ham farqlanadi. Eng yumshoqlari gidroksidi metallardir, ularni pichoq bilan osongina kesish mumkin; Eng qattiq metall - xrom shishani kesadi. Metalllarning erish nuqtalarida katta farq bor: simob normal sharoitda suyuqlikdir, seziy va galliy inson tanasining haroratida eriydi va eng o'tga chidamli metall volframning erish nuqtasi 3380 ° S ni tashkil qiladi. Erish nuqtasi 1000 ° C dan yuqori bo'lgan metallar o'tga chidamli metallar deb tasniflanadi va undan past bo'lganlar eruvchan metallar deb ataladi. Yuqori haroratlarda metallar elektronlarni chiqarishga qodir, ular elektronika va termoelektr generatorlarida issiqlik energiyasini bevosita elektr energiyasiga aylantirish uchun ishlatiladi. Temir, kobalt, nikel va gadoliniy ularni magnit maydonga joylashtirgandan so'ng doimiy ravishda magnitlanish holatini saqlab turishga qodir.
Metalllar ham ba'zi kimyoviy xususiyatlarga ega. Metall atomlari nisbatan osonlik bilan valentlik elektronlaridan voz kechib, musbat zaryadlangan ionlarga aylanadi. Shuning uchun metallar qaytaruvchi moddalardir. Bu, aslida, ularning asosiy va eng umumiy kimyoviy xossasidir.
Shubhasiz, qaytaruvchi moddalar sifatida metallar turli xil oksidlovchi moddalar bilan reaksiyaga kirishadi, ular oddiy moddalar, kislotalar, kamroq faol metallarning tuzlari va boshqa ba'zi birikmalarni o'z ichiga olishi mumkin. Metalllarning galogenli birikmalari galogenidlar, oltingugurt bilan - sulfidlar, azot bilan - nitridlar, fosfor bilan - fosfidlar, uglerod bilan - karbidlar, kremniy bilan - silisidlar, bor bilan - boridlar, vodorod bilan - gidridlar va boshqalar deb ataladi. Bu birikmalarning ko'pchiligi. yangi texnologiyada muhim ilovalarni topdi. Masalan, metall boridlar radioelektronikada, shuningdek, yadroviy muhandislikda neytron nurlanishini tartibga solish va himoya qilish uchun materiallar sifatida ishlatiladi.
Konsentrlangan oksidlovchi kislotalar ta'sirida ba'zi metallarda barqaror oksidli plyonka ham hosil bo'ladi. Ushbu hodisa passivatsiya deb ataladi. Shunday qilib, konsentrlangan sulfat kislotada Be, Bi, Co, Fe, Mg, Nb kabi metallar passivlanadi (va u bilan reaksiyaga kirishmaydi), konsentrlangan nitrat kislotada esa Al, Be, Bi, Co, Cr, Fe, Nb, Ni, Pb, Th va U.
Metall bu qatorda qanchalik chapga joylashgan bo'lsa, uning qaytaruvchi xossalari shunchalik katta bo'ladi, ya'ni oksidlanish va kation sifatida eritmaga kirish osonroq, ammo kationdan erkin holatga keltirish qiyinroq. .
Voltaj qatoriga bitta metall bo'lmagan vodorod joylashtirilgan, chunki bu metallning suvli eritmadagi oksidlanmaydigan kislotalar bilan reaksiyaga kirishishini aniqlashga imkon beradi (aniqrog'i, vodorod kationlari H+ bilan oksidlanadi). Masalan, rux xlorid kislotasi bilan reaksiyaga kirishadi, chunki kuchlanishlar qatorida u vodoroddan chap tomonda (oldin) joylashgan. Aksincha, kumush xlorid kislota bilan eritmaga o'tmaydi, chunki u vodorodning o'ng tomonida (keyin) kuchlanish qatorida joylashgan. Suyultirilgan sulfat kislotada metallar xuddi shunday harakat qiladi. Vodoroddan keyin kuchlanish qatoridagi metallar olijanob (Ag, Pt, Au va boshqalar) deb ataladi.
Metalllarning kiruvchi kimyoviy xossasi ularning elektrokimyoviy korroziyasi, ya'ni suv bilan aloqa qilganda va unda erigan kislorod ta'sirida metallning faol yo'q qilinishi (oksidlanishi) (kislorod korroziyasi). Masalan, temir mahsulotlarining suvda korroziyasi keng tarqalgan.
Ayniqsa, korroziy xavfli ikkita o'xshash bo'lmagan metallarning aloqa joyi bo'lishi mumkin - kontaktli korroziya. Galvanik juftlik Fe kabi bir metall va suvga joylashtirilgan Sn yoki Cu kabi boshqa metall o'rtasida sodir bo'ladi. Elektronlar oqimi kuchlanish seriyasida (Fe) chapda joylashgan faolroq metalldan kamroq faol metallga (Sn, Cu) o'tadi va faolroq metall yo'q qilinadi (korroziyaga uchraydi).
Shu sababli konservalangan konserva yuzasi (qalay bilan qoplangan temir) nam muhitda saqlangan va ehtiyotsizlik bilan ishlaganda zanglab ketadi (temir hatto kichik tirnalgandan keyin ham tezda qulab tushadi, bu esa dazmolning namlik bilan aloqa qilishiga imkon beradi). Aksincha, temir chelakning galvanizli yuzasi uzoq vaqt zanglamaydi, chunki tirnalgan bo'lsa ham, temir emas, balki sink (temirdan ko'ra faolroq metall) korroziyaga uchraydi.
Berilgan metallning korroziyaga chidamliligi faolroq metall bilan qoplanganida yoki ular eritilganda ortadi; Shunday qilib, temirni xrom bilan qoplash yoki temir va xrom qotishmalarini tayyorlash temirning korroziyasini yo'q qiladi. Xromli temir va xrom o'z ichiga olgan po'latlar (zanglamaydigan po'latlar) yuqori korroziyaga chidamliligiga ega.
Metall olishning umumiy usullari:
Elektrometallurgiya, ya'ni eritmalarni (eng faol metallar uchun) yoki ularning tuzlari eritmalarini elektroliz qilish orqali metallarni ishlab chiqarish;
Pirometallurgiya, ya'ni yuqori haroratda ularning rudalaridan metallarni kamaytirish (masalan, yuqori o'choq jarayoni yordamida temir ishlab chiqarish);
Gidrometallurgiya, ya'ni metallarni ularning tuzlari eritmalaridan faolroq metallar bilan ajratish (masalan, CuSO4 eritmasidan rux, temirni almashtirish orqali mis olish).
yoki alyuminiy).
Tabiatda metallar ba'zan erkin shaklda, masalan, mahalliy simob, kumush va oltin, ko'pincha birikmalar (metall rudalari) shaklida uchraydi. Eng faol metallar, albatta, er qobig'ida faqat bog'langan holda mavjud.
Litiy (yunoncha Lithos — tosh), Li, davriy sistemaning Ia kichik guruhining kimyoviy elementi; atom raqami 3, atom massasi 6, 941; ishqoriy metallarni nazarda tutadi.
Yer qobig'idagi litiy miqdori massa bo'yicha 6,5-10-3% ni tashkil qiladi. U 150 dan ortiq minerallarda uchraydi, shundan 30 ga yaqini litiy minerallari.Asosiy minerallar spodumen LiAl, lepidolit KLi1,5 Al1,5(F.0H)2 va petalit (LiNa). Ushbu minerallarning tarkibi murakkab, ularning ko'pchiligi er qobig'ida juda keng tarqalgan aluminosilikatlar sinfiga kiradi. Litiy ishlab chiqarish uchun xom ashyoning istiqbolli manbalari tuzli konlarning sho'rlari (sho'rlari) va er osti suvlaridir. Litiy birikmalarining eng yirik konlari Kanada, AQSh, Chili, Zimbabve, Braziliya, Namibiya va Rossiyada joylashgan.
Qizig'i shundaki, spodumen minerali tabiatda bir necha tonna og'irlikdagi yirik kristallar shaklida uchraydi. AQShdagi Etta konida uzunligi 16 m, og‘irligi 100 tonna bo‘lgan igna shaklidagi kristall topildi.
Litiy haqidagi birinchi maʼlumotlar 1817-yilga toʻgʻri keladi.Shved kimyogari A.Arfvedson mineral petalitni tahlil qilar ekan, unda nomaʼlum ishqor topdi. Arfvedsonning o'qituvchisi J. Berzelius unga "lition" (yunoncha litheos - tosh) nomini bergan, chunki o'simlik kulidan olingan kaliy va natriy gidroksidlaridan farqli o'laroq, mineralda yangi ishqor topilgan. U, shuningdek, ushbu ishqorning "asos" bo'lgan metallni litiy deb atadi. 1818 yilda ingliz kimyogari va fizigi G. Davy LiOH gidroksidni elektroliz qilish orqali litiy oldi.
Xususiyatlari. Litiy kumush-oq metalldir; m.p. 180,54 °C, bp. 1340 "C; barcha metallar ichida eng engili, uning zichligi 0,534 g/sm ni tashkil etadi - u alyuminiydan 5 baravar engil va suvning deyarli yarmiga teng. Litiy yumshoq va egiluvchan. Litiy birikmalari olovni chiroyli karmin qizil rangga bo'yaydi. Bu juda sezgir usul litiyni aniqlash uchun sifatli tahlilda qo'llaniladi.
Litiy atomining tashqi elektron qatlamining konfiguratsiyasi 2s1 (s-element). Aralashmalarda u +1 oksidlanish darajasini ko'rsatadi.
Litiy elektrokimyoviy kuchlanish seriyasida birinchi bo'lib, vodorodni nafaqat kislotalardan, balki suvdan ham siqib chiqaradi. Biroq, litiyning ko'pgina kimyoviy reaktsiyalari boshqa gidroksidi metallarga qaraganda kamroq kuchli.
Xona haroratida namlik to'liq bo'lmasa, lityum havo komponentlari bilan deyarli reaksiyaga kirishmaydi. 200 ° C dan yuqori havoda qizdirilganda, asosiy mahsulot sifatida Li2O oksidi hosil bo'ladi (faqat Li2O2 peroksid izlari mavjud). Nam havoda u asosan Li3N nitridi hosil qiladi, havo namligi 80% dan yuqori bo'lsa, LiOH gidroksid va Li2CO3 karbonat hosil qiladi. Litiy nitridini metallni azot oqimida qizdirish orqali ham olish mumkin (litiy azot bilan bevosita birikadigan oz sonli elementlardan biridir): 6Li + N2 = 2Li3N
Litiy deyarli barcha metallar bilan oson qotishadi va simobda yaxshi eriydi. To'g'ridan-to'g'ri galogenlar bilan birlashadi (qizdirilganda yod bilan). 500 ° C da u vodorod bilan reaksiyaga kirishib, LiH gidridini hosil qiladi, suv bilan - LiOH gidroksidi, suyultirilgan kislotalar bilan - litiy tuzlari, ammiak bilan - LiNH2 amid, masalan:
2Li + H2 = 2LiH
2Li + 2H2O = 2LiOH + H2
2Li + 2NF = 2LiF + N2
2Li + 2NH3 = 2LiNH2 + H2
LiH gidridi - rangsiz kristallar; kimyoning turli sohalarida qaytaruvchi vosita sifatida ishlatiladi. Suv bilan o'zaro ta'sirlashganda u ko'p miqdorda vodorodni chiqaradi (1 kg LiH dan 2820 l H2 olinadi):
LiH + H2O = LiOH + H2
Bu LiH dan havo sharlari va qutqaruv uskunalarini to'ldirish uchun vodorod manbai sifatida foydalanishga imkon beradi (shishiriladigan qayiqlar, kamarlar va boshqalar), shuningdek, yonuvchan vodorodni saqlash va tashish uchun o'ziga xos "ombor" (uni himoya qilish kerak). Namlikning eng kichik izlaridan LiH).
Aralash lityum gidridlar organik sintezda keng qo'llaniladi, masalan, lityum alyuminiy gidrid LiAlH4, selektiv qaytaruvchi vosita. LiH ni alyuminiy xlorid AlCl3 bilan reaksiyaga kiritish orqali olinadi
LiOH gidroksidi kuchli asos (gidroksidi), uning suvli eritmalari shisha va chinni yo'q qiladi; Nikel, kumush va oltin unga chidamli. LiOH gidroksidi akkumulyatorlarning elektrolitiga qo'shimcha sifatida ishlatiladi, bu ularning ishlash muddatini 2-3 barobarga va quvvatini 20% ga oshiradi. LiOH va organik kislotalar (ayniqsa stearik va palmitik) asosida metallarni -40 dan +130 "S gacha bo'lgan harorat oralig'ida korroziyadan himoya qilish uchun sovuqqa va issiqlikka chidamli yog'lar (litollar) ishlab chiqariladi.
Litiy gidroksidi gaz maskalari, suv osti kemalari, samolyotlar va kosmik kemalarda karbonat angidridni yutuvchi sifatida ham qo'llaniladi.
Kvitansiya va ariza. Litiy ishlab chiqarish uchun xom ashyo uning tuzlari bo'lib, ular minerallardan olinadi. Tarkibiga qarab minerallar sulfat kislota H2SO4 (kislota usuli) yoki kaltsiy oksidi CaO va uning karbonati CaCO3 (ishqoriy usul), kaliy sulfat K2SO4 (tuz usuli), kaltsiy karbonat va uning xlorid CaCl (ishqoriy) bilan sinterlash orqali parchalanadi. -tuz usuli). Kislota usuli yordamida Li2SO4 sulfat eritmasi olinadi [ikkinchisi kaltsiy gidroksid Ca(OH)2 va soda Na2Co3 bilan ishlov berish orqali aralashmalardan tozalanadi]. Mineral parchalanishning boshqa usullari bilan hosil bo'lgan kek suv bilan yuviladi; bu holda ishqoriy usul bilan LiOH eritmaga, tuz usuli bilan - Li 2SO4, gidroksidi-tuz usuli bilan - LiCl kiradi. Ishqoriydan tashqari barcha bu usullar Li2CO3 karbonat shaklida tayyor mahsulotni ishlab chiqarishni ta'minlaydi. to'g'ridan-to'g'ri yoki boshqa lityum birikmalarini sintez qilish uchun manba sifatida ishlatiladi.
Lityum metall LiCl va kaliy xlorid KCl yoki bariy xlorid BaCl2 ning erigan aralashmasini elektroliz qilish va aralashmalardan keyingi tozalash orqali ishlab chiqariladi.
Litiyga qiziqish juda katta. Bu, birinchi navbatda, vodorod bombasining asosiy komponenti va termoyadroviy reaktorlar uchun asosiy yoqilg'i bo'lgan tritiy (og'ir vodorod nuklidi) ni sanoat ishlab chiqarish manbai ekanligi bilan bog'liq. Termoyadro reaktsiyasi nuklid 6Li va neytronlar (massa raqami 1 bo'lgan neytral zarralar) o'rtasida sodir bo'ladi; reaksiya mahsulotlari - tritiy 3H va geliy 4He:
63Li + 10n= 31 H +42He
Metallurgiyada katta miqdorda litiy ishlatiladi. 10% litiyli magniy qotishmasi magniyning o'zidan kuchliroq va engilroq. Alyuminiy va litiy qotishmalari - tarkibida atigi 0,1% litiy bo'lgan skleron va aeron, engillikdan tashqari, yuqori mustahkamlik, egiluvchanlik va korroziyaga chidamliligini oshiradi; ular aviatsiyada qo'llaniladi. Qo'rg'oshin-kaltsiyli qotishmalarga 0,04% litiy qo'shilishi ularning qattiqligini oshiradi va ishqalanish koeffitsientini kamaytiradi.
Litiy galogenidlar va karbonat optik, kislotaga chidamli va boshqa maxsus oynalar, shuningdek, issiqqa chidamli chinni va keramika, turli sir va emallarni ishlab chiqarishda qo'llaniladi.
Nozik litiy zarralari nam teri va ko'zning kimyoviy kuyishiga olib keladi. Lityum tuzlari terini bezovta qiladi. Litiy gidroksid bilan ishlaganda, natriy va kaliy gidroksidlari bilan ishlashda bo'lgani kabi ehtiyot choralarini ko'rish kerak.
Natriy (arab, natrun, yunoncha nitron — tabiiy soda, davriy tizimning Ia kichik guruhining kimyoviy elementi; atom raqami 11, atom ogʻirligi 22,98977; ishqoriy metallarga kiradi. Tabiatda u bir turgʻun nuklid holida uchraydi. 23 Na.
Hatto qadimgi davrlarda ham natriy birikmalari ma'lum bo'lgan - osh tuzi (natriy xlorid) NaCl, gidroksidi (natriy gidroksid) NaOH va soda (natriy karbonat) Na2CO3. Oxirgi moddani qadimgi yunonlar "nitron" deb atashgan; Bu metallning zamonaviy nomi - "natriy" dan kelib chiqqan. Biroq, Buyuk Britaniya, AQSh, Italiya, Frantsiyada natriy so'zi (rus tilidagi kabi ma'noga ega bo'lgan ispancha "soda" so'zidan) saqlanib qolgan.
Natriy (va kaliy) ning ishlab chiqarilishi haqida birinchi marta ingliz kimyogari va fizigi G. Deyvi 1807 yilda Londonda qirollik jamiyatining yig'ilishida ma'lum qildi. U elektr toki yordamida gidroksidi KOH va NaOH ni parchalashga va ilgari noma'lum bo'lgan metallarni ajratib olishga muvaffaq bo'ldi. ajoyib xususiyatlarga ega. Bu metallar havoda juda tez oksidlanib, suv yuzasida suzib yurib, undan vodorod ajralib chiqdi.
Tabiatda tarqalishi. Natriy tabiatdagi eng keng tarqalgan elementlardan biridir. Uning er qobig'idagi miqdori og'irlik bo'yicha 2,64% ni tashkil qiladi. Gidrosferada u eruvchan tuzlar shaklida taxminan 2,9% miqdorida (dengiz suvidagi tuzlarning umumiy konsentratsiyasi 3,5-3,7%) mavjud. Quyosh atmosferasida va yulduzlararo fazoda natriy borligi aniqlangan. Tabiatda natriy faqat tuzlar holida uchraydi. Eng muhim minerallar: galit (tosh tuzi) NaCl, mirabilit (Glauber tuzi) Na2SO4 *10H2O, tenardit Na2SO4, chelian nitrat NaNO3, tabiiy silikatlar, masalan, albit Na, nefelin Na.
Rossiya tosh tuzi konlariga (masalan, Solikamsk, Usolye-Sibirskoye va boshqalar), Sibirdagi trona mineralining yirik konlariga juda boy.
Xususiyatlari. Natriy kumush-oq, erituvchi metall, mp. 97,86 °C, bp. 883,15 °C. Bu eng engil metallardan biri - u suvdan engilroq, zichligi 0,99 g / sm3 19,7 ° C da). Natriy va uning birikmalari yondirgich alangasini sariq rangga bo'yadi. Bu reaktsiya shunchalik sezgirki, u hamma joyda (masalan, ichki yoki tashqi changda) natriyning eng kichik izlari mavjudligini aniqlaydi.
Natriy davriy jadvalning eng faol elementlaridan biridir. Natriy atomining tashqi elektron qatlami bitta elektronni o'z ichiga oladi (3s1 konfiguratsiyasi, natriy s-element). Natriy o'zining yagona valentlik elektronidan osongina voz kechadi va shuning uchun uning birikmalarida har doim +1 oksidlanish darajasini ko'rsatadi.
Havoda natriy faol oksidlanib, sharoitga qarab Na2O oksidi yoki Na2O2 peroksid hosil qiladi. Shuning uchun natriy kerosin yoki mineral moy qatlami ostida saqlanadi. Vodorodni almashtirib, suv bilan kuchli reaksiyaga kirishadi:
2Na + H20 = 2NaOH + H2
Bu reaktsiya muz bilan -80 ° C haroratda ham sodir bo'ladi va iliq suvda yoki aloqa yuzasida portlash bilan sodir bo'ladi (ular bejiz aytishmaydi: "Agar siz jinni bo'lishni xohlamasangiz, natriyni suvga tashlamang”).
Natriy to'g'ridan-to'g'ri barcha nometallar bilan reaksiyaga kirishadi: 200 ° C da u vodorodni o'zlashtira boshlaydi, juda gigroskopik gidrid NaH hosil qiladi; elektr razryadda azot bilan nitridi Na3N yoki azid NaN3 hosil qiladi; ftorli atmosferada u yonadi; haroratda xlor kuyishida; faqat qizdirilganda brom bilan reaksiyaga kirishadi:
2Na + H2 = 2NaH
6Na + N2=2Na3N yoki 2Na+ 3Na2=2NaN3
2Na+ S12 = 2NaSl
800-900 ° S da natriy uglerod bilan birlashadi va Na2C2 karbidini hosil qiladi; oltingugurt bilan maydalanganda Na2S sulfid va polisulfidlar aralashmasini (Na2S3 va Na2S4) beradi.
Natriy suyuq ammiakda oson eriydi, hosil bo'lgan ko'k rangli eritma metall o'tkazuvchanlikka ega, gazsimon ammiak 300-400 ° C da yoki katalizator ishtirokida -30 ° C gacha sovutilganda amid NaNH2 ni beradi.
Natriy kumush, oltin, kadmiy, qo'rg'oshin, kaliy va boshqalar kabi boshqa metallar (intermetalik birikmalar) bilan birikmalar hosil qiladi. Simob bilan u amalgamlar NaHg2, NaHg4 va boshqalarni hosil qiladi. Eng muhimi suyuq amalgamlar bo'lib, ular natriyning kerosin yoki mineral moy qatlami ostida joylashgan simobga bosqichma-bosqich kiritilishi natijasida hosil bo'ladi.
Natriy suyultirilgan kislotalar bilan tuzlar hosil qiladi.
Kvitansiya va ariza. Natriy olishning asosiy usuli erigan osh tuzining elektrolizidir. Bunda anodda xlor, katodda esa natriy ajralib chiqadi. Elektrolitning erish nuqtasini kamaytirish uchun osh tuziga boshqa tuzlar qo'shiladi: KCl, NaF, CaCl2. Elektroliz diafragmali elektrolizatorlarda amalga oshiriladi; anodlar grafitdan, katodlar mis yoki temirdan tayyorlanadi.
Natriyni erigan NaOH gidroksidni elektroliz qilish, oz miqdorda esa NaN3 azidni parchalash orqali olish mumkin.
Metall natriy ularning birikmalaridan sof metallarni tiklash uchun ishlatiladi - kaliy (KOH dan), titan (TiCl4 dan) va boshqalar. Natriyning kaliy bilan qotishmasi yadro reaktorlari uchun sovutuvchi vositadir, chunki gidroksidi metallar neytronlarni yaxshi singdirmaydi va shuning uchun uran yadrolarining bo'linishiga to'sqinlik qilmaydi. Yorqin sariq rangga ega bo'lgan natriy bug'i avtomobil yo'llari, marinalar, temir yo'l vokzallari va boshqalarni yoritish uchun ishlatiladigan gaz-razryad lampalarini to'ldirish uchun ishlatiladi. Natriy tibbiyotda qo'llaniladi: sun'iy ravishda ishlab chiqarilgan nuklid 24Na ba'zi shakllarini radiologik davolash uchun ishlatiladi. leykemiya va diagnostika maqsadida.
Natriy birikmalaridan foydalanish ancha kengroq.
Na2O2 peroksid rangsiz kristall, sariq rangli texnik mahsulotdir. 311-400 ° S gacha qizdirilganda u kislorodni chiqara boshlaydi va 540 ° C da tez parchalanadi. Kuchli oksidlovchi vosita bo'lib, u mato va boshqa materiallarni oqartirish uchun ishlatiladi. Havoda u CO2 ni yutadi, kislorod chiqaradi va karbonat 2Na2O2+2CO2=2Na2Co3+O2 hosil qiladi). Na2O2 dan yopiq joylarda va izolyatsiyalovchi nafas olish qurilmalarida (suv osti kemalari, izolyatsion gaz maskalari va boshqalar) havo regeneratsiyasi uchun foydalanish ushbu xususiyatga asoslanadi.
NaOH gidroksidi; eskirgan nomi kaustik soda, texnik nomi kaustik soda (lotincha kaustikdan - kaustik, yonish); eng mustahkam asoslaridan biri. Texnik mahsulot, NaOH dan tashqari, aralashmalarni (3% gacha Na2CO3 va 1,5% NaCl) o'z ichiga oladi. NaOH ning katta miqdori gidroksidi batareyalar uchun elektrolitlar tayyorlash, qog'oz, sovun, bo'yoq, tsellyuloza ishlab chiqarish uchun ishlatiladi va neft va moylarni tozalash uchun ishlatiladi.
Natriy tuzlari orasida Na2CrO4 xromati - bo'yoqlar ishlab chiqarishda, matolarni bo'yash uchun mordan sifatida va charm sanoatida ko'nchilik vositasi sifatida ishlatiladi; sulfit Na2SO3 - fotografiyada fiksatorlar va ishlab chiquvchilarning tarkibiy qismi; gidrosulfit NaHSO3 - meva, sabzavotlar va o'simlik ozuqalarini saqlash uchun ishlatiladigan matolar va tabiiy tolalar uchun oqartiruvchi vosita; tiosulfat Na2S2O3 - matolarni oqartirishda xlorni olib tashlash uchun, fotosuratda fiksator, simob birikmalari, mishyak va boshqalar bilan zaharlanish uchun antidot, yallig'lanishga qarshi vosita sifatida; xlorat NaClO3 - turli xil pirotexnika tarkibidagi oksidlovchi vosita; Na5P3O10 trifosfat suvni yumshatish uchun sintetik yuvish vositalariga qo'shimcha hisoblanadi.
Natriy, NaOH va uning eritmalari teri va shilliq pardalarning qattiq kuyishiga olib keladi.
Tashqi ko'rinishi va xususiyatlariga ko'ra kaliy natriyga o'xshaydi, lekin ko'proq reaktivdir. Suv bilan kuchli reaksiyaga kirishadi va vodorodning alangalanishiga olib keladi. U havoda yonib, to'q sariq rangli superoksid CO2 hosil qiladi. Xona haroratida u halogenlar bilan, o'rtacha isitish bilan - vodorod va oltingugurt bilan reaksiyaga kirishadi. Nam havoda u tezda KOH qatlami bilan qoplanadi. Kaliyni benzin yoki kerosin qatlami ostida saqlang.
Eng katta amaliy qo'llanmalar kaliy birikmalari - KOH gidroksidi, KNO3 nitrat va K2CO3 karbonatdir.
Kaliy gidroksid KOH (texnik nomi - o'yuvchi kaliy) - nam havoda tarqaladigan va karbonat angidridni o'zlashtiradigan oq kristallar (K2CO3 va KHCO3 hosil bo'ladi). Yuqori ekzo effektli suvda juda eriydi. Suvli eritma juda ishqoriydir.
Kaliy gidroksid KCl eritmasini elektroliz qilish natijasida hosil bo'ladi (NaOH ishlab chiqarishga o'xshash). Asl kaliy xlorid KCl tabiiy xom ashyolardan (minerallar silvit KCl va karnallit KMgC13 6H20) olinadi. KOH turli xil kaliy tuzlari, suyuq sovun, bo'yoqlarni sintez qilish uchun, batareyalarda elektrolit sifatida ishlatiladi.
Kaliy nitrat KNO3 (mineral kaliy nitrat) - oq kristallar, ta'mi juda achchiq, erish nuqtasi past (eritma = 339 ° C). Suvda yaxshi eriydi (gidrolizsiz). Erish nuqtasidan yuqori qizdirilganda u kuchli oksidlovchi xususiyatga ega bo'lgan kaliy nitriti KNO2 va kislorod O2 ga parchalanadi. Oltingugurt va ko'mir eritilgan KNO3 bilan aloqa qilganda yonadi va C + S aralashmasi portlaydi ("qora kukun" yonishi):
2KNO3 + ZS(ko'mir) + S=N2 + 3CO2 + K2S
Kaliy nitrat shisha va mineral o'g'itlar ishlab chiqarishda ishlatiladi.
Kaliy karbonat K2CO3 (texnik nomi - kaliy) oq gigroskopik kukundir. U suvda juda yaxshi eriydi, anionda kuchli gidrolizlanadi va eritmada ishqoriy muhit hosil qiladi. Shisha va sovun tayyorlashda ishlatiladi.
K2CO3 ishlab chiqarish quyidagi reaktsiyalarga asoslanadi:
K2SO4 + Ca(OH)2 + 2CO = 2K(HCOO) + CaSO4
2K(NSOO) + O2 = K2S03 + N20 + S02
Tabiiy xomashyodan kaliy sulfat (minerallar kainit KMg(SO4)Cl ZH20 va schoenite K2Mg(SO4)2 * 6H20) so‘ndirilgan ohak Ca(OH)2 bilan CO atmosferasida (15 atm bosim ostida), kaliy formatida isitiladi. K(HCOO) olinadi. , u havo oqimida kalsinlanadi.
Kaliy o'simliklar va hayvonlar uchun muhim element hisoblanadi. Kaliyli o'g'itlar - kaliy tuzlari, ham tabiiy, ham ularning qayta ishlangan mahsulotlari (KCl, K2SO4, KNO3); o'simlik kulida kaliy tuzlarining yuqori miqdori.
Kaliy yer qobig'idagi to'qqizinchi elementdir. Minerallarda, dengiz suvida (1 litrda 0,38 g K+ ionlarigacha), o'simliklarda va tirik organizmlarda (hujayra ichida) faqat bog'langan holda mavjud. Inson tanasida = 175 g kaliy mavjud, kunlik ehtiyoj ~ 4 g ga etadi. Radioaktiv izotopi 40K (asosiy barqaror izotop 39K aralashmasi) juda sekin parchalanadi (yarimparchalanish davri 1109 yil), u 238U va 232Th izotoplari bilan birgalikda katta hissa qo'shadi.