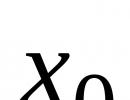Lipoproteiny (Lipoproteiny) - co to je. Transport lipidů je samostatným úkolem Hlavní skupiny sérových lipoproteinů
Hlavními lipidy nacházejícími se v krevní plazmě jsou cholesterol, triglyceridy a fosfolipidy. Pro tělo jsou životně nezbytné pro vykonávání mnoha funkcí, ale vzhledem k jejich vlastnostem, zejména jejich nerozpustné struktuře, jsou proteiny - apolipoproteiny - nutné pro jejich přenos do buněk tkání a orgánů. Vazbou na ně se lipidy mohou volně pohybovat spolu s průtokem krve.
Lipoproteiny krevní plazmy jsou tedy komplexem proteinů a lipidů, které mají ve vodě rozpustnou strukturu, což jim umožňuje aktivně se zapojit do metabolických procesů.
Všechny známé lipoproteiny obsahují cholesterol, triglyceridy a fosfolipidy, ale jejich podíly se liší v závislosti na frakci lipidové sloučeniny. Lipoproteiny se liší i v dalších parametrech: velikost sloučeniny, skupiny apoproteinů, rychlost flotace, hustota komplexu.
Klasifikace lipoproteinů
Dnes je známo mnoho různých klasifikací lipidových komplexů, ale nejznámější a nejoblíbenější je klasifikace založená na pořadí, ve kterém se lipoproteiny pohybují od startovní čáry v gravitačním poli při ultracentrifugaci.
Rozlišují se následující frakce lipoproteinů:
- (HM);
- lipoproteiny s nízkou hustotou (LDL);
- (VLDL);
- lipoproteiny se střední hustotou (IDL);
- hustota (HDL).
Přítomnost těchto sloučenin v krvi je stanovena biochemií nebo lipidovým profilem.
Každá skupina lipoproteinů má různé velikosti částic obsažených ve sloučenině a také obsah bílkovin v nich je odlišný. Podívejme se v tabulce na hlavní charakteristiky transportních forem lipidů.
Tabulka srovnávacích charakteristik lipoproteinů
| HM | LDL | VLDL | BOB | HDL | |
|---|---|---|---|---|---|
| Obsah bílkovin, % | 2 | 22 | 10 | 11 | 50 |
| Obsah cholesterolu, % | 2 | 8 | 7 | 8 | 4 |
| Velikost částic, nm | 75-1200 | 18-26 | 30-80 | 25-35 | 8-11 |
| Místo vzdělávání | Epitel tenkého střeva | Krev | Jaterní buňky | Krev | Jaterní buňky |
| Funkce | Transport mastných kyselin a cholesterolu, které pocházejí z potravy, ze střeva do jaterních buněk a periferních tkání. | Transport lipidů z jaterních buněk do periferních tkání. | Mezilehlá forma konverze VLDL na LDL. | Transport lipidů z periferních tkání do jaterních buněk, odstranění přebytečného cholesterolu z jiných lipoproteinů a buněk těla. |
Všechny jmenované frakce lipoproteinů jsou vzájemně neoddělitelně propojeny, poskytují tělesným buňkám dostatečnou výživu a jsou základem biochemie mnoha procesů. Pokud je pod vlivem různých faktorů pozorována porucha metabolismu lipoproteinů, je narušena přirozená rovnováha lipidů v krvi a v těle se začnou vyvíjet patologické procesy, z nichž hlavním je aterosklerotické poškození cév. Podívejme se na tyto krevní lipoproteiny podrobněji.
Chylomikrony
K tvorbě těchto krevních lipoproteinů dochází v epiteliálních buňkách střeva po trávení potravy a absorpci tuků z tenkého střeva. Poté se dostávají do mezibuněčného prostoru a dále se vstřebávají do lymfatických kapilár klků. Jsou to největší lipoproteinové sloučeniny v průměru.

Chylomikrony transportují cholesterol, triglyceridy a exogenní mastné kyseliny v krvi. 85 % cholesterolu se skládá z triglyceridů, takže jsou klasifikovány jako lipoproteiny bohaté na triglyceridy. Tyto lipidové sloučeniny jsou nezbytné pro transport triglyceridů v prvních několika hodinách po požití. Předpokládá se, že normálně 12 hodin po posledním jídle úplně zmizí z krevní plazmy.
Při metabolismu lipidů se tyto komplexy vyskytují v krvi s lipoproteiny o vysoké hustotě a vyměňují si různé podtypy proteinů – apoproteiny. Při jejich odbourávání se uvolňují estery cholesterolu a bílkoviny, z nichž některé jsou vázány lipoproteiny s vysokou hustotou a zbytek se dostává do jaterních buněk, tam se přeměňuje a vylučuje z těla.
LDL
Tato frakce lipoproteinů je považována za nejvíce aterogenní, protože obsahuje průměrně 45 % cholesterolu a je její hlavní transportní formou, přičemž zároveň usnadňuje transport karotenoidů, triglyceridů, vitaminu E a některých dalších složek. Navíc je v těchto sloučeninách koncentrováno asi 60-70 % veškerého cholesterolu v séru.

Při procesu lipolýzy tyto sloučeniny vznikají z VLDL, přičemž ve vzniklém komplexu klesá obsah triglyceridů a naopak stoupá cholesterol. Tyto struktury jsou tedy konečnou fází metabolismu lipidů produkovaných jaterními buňkami.
Předpokládá se, že je to koncentrace těchto lipoproteinů v krvi, která plněji odráží pravděpodobnost aterosklerotických lézí cévních stěn, dokonce i hladina cholesterolu je v tomto ohledu méně důležitá.
V důsledku poruch metabolismu lipoproteinů o nízké hustotě, zejména ve směru zvyšování jejich hladiny v krvi, se u člověka začínají objevovat závažná onemocnění, zvláště pokud není včas zahájena normalizace. Důvody takového porušení mohou být:
- špatná výživa;
- onemocnění jater;
- dědičné poruchy metabolismu lipidů;
- kouření a nadměrná konzumace alkoholu;
- endokrinní onemocnění;
- sedavý způsob života.
Abyste mohli tento indikátor neustále sledovat, musíte každý rok provádět biochemii krve a pokud je zjištěna sebemenší odchylka od normy, přijmout vhodná opatření.
VLDL
Tato frakce lipoproteinů je svým složením a strukturou podobná chylomikronu, ale je menší velikosti. Obsahují méně triglyceridů, ale více apolipoproteinů, fosfolipidů a cholesterolu. V tomto případě jsou VLDL spolu s chylomikrony klasifikovány jako lipoproteiny bohaté na triglyceridy.

Místo syntézy těchto komplexů se nazývá jaterní buňky a jejich hlavním úkolem je transport triglyceridů vytvořených ve stejném orgánu. Tyto komplexy také transportují cholesterol, cholesterylestery a fosfolipidy do tělesných buněk.
Rychlost tvorby těchto lipoproteinových frakcí se mění v závislosti na určitých podmínkách: zvyšuje se se zvýšeným přísunem volných mastných kyselin a velkého množství sacharidů do jater.
VLDL jsou prekurzory lipoproteinů s nízkou hustotou, protože v důsledku hydrolýzy působením enzymu lipoproteinové lipázy se první rozpadnou a vytvoří se intermediární forma lipidů - LDLP, které se následně přeměňují na LDL v procesu stejná hydrolýza.
VLDL se nazývají vysoce aterogenní sloučeniny, protože patří mezi zdroje „špatného“ cholesterolu v těle. Pokud jsou tyto komplexy v krvi zvýšené, vytváří to předpoklady pro rozvoj aterosklerózy a jejích následků. Za hlavní důvod zvýšení jejich hladiny je považována dědičná dispozice a nadměrný příjem živočišných tuků z potravy. Jiné příčiny této patologie mohou být:
- onemocnění jater a žlučníku;
- endokrinní poruchy;
- obezita;
- alkoholismus;
- onemocnění ledvin, zejména v chronické formě.
BOB
Tyto strukturní sloučeniny se tvoří v krevní plazmě při přeměně VLDL na LDL a často se nazývají zbytkové VLDL. Pod vlivem enzymu lipoproteinové lipázy se lipoproteiny s velmi nízkou hustotou přeměňují na jinou formu - LDLP, z nichž polovina je zcela vyloučena z těla v procesu složitých biochemických reakcí a druhá část v důsledku hydrolýzy účast jaterní lipázy se mění na LDL.
Složení těchto částic se podobá kříženci mezi kompozicemi lipoproteinů s nízkou a velmi nízkou hustotou. Bylo zjištěno, že u zdravých lidí v krvi odebrané nalačno tyto komplexy buď zcela chybí, nebo je jejich koncentrace desetkrát nižší než hladina LDL.
Hlavním důvodem zvýšení koncentrace těchto sloučenin v krevní plazmě je prý dědičná predispozice a strava bohatá na živočišné tuky. Tento faktor přispívá k rozvoji kardiovaskulárních onemocnění.
HDL
Tyto sloučeniny se nazývají antiaterogenní, protože nevedou ke zvýšení hladiny „špatného“ cholesterolu v krvi, ale naopak při dostatečné koncentraci přispívají k jeho navázání a odstranění z těla. Tvoří se v jaterních buňkách a jsou z poloviny složeny z bílkovin, tj. mají nejvyšší možnou hustotu. Jejich obsah cholesterolu je přitom minimální. Mají nejmenší velikost a mají tvar disku, proto se v úzkých kruzích HDL označuje jako „disky“.

K syntéze těchto částic dochází v jaterních buňkách, po jejich uvolnění se navážou na fosfolipidy a začnou interagovat s jinými frakcemi lipoproteinů a tělesnými buňkami, zachycují cholesterol a získávají plnou formu lipidové sloučeniny. Tímto způsobem HDL dodává přebytečný cholesterol zpět do jaterních buněk, kde podléhá rozkladu a vylučování prostřednictvím gastrointestinálního traktu.
Jinými slovy, dochází k neustálé výměně cholesterolu mezi LDL a HDL, přičemž tok cholesterolu směřuje k HDL. „Dobré“ lipoproteiny přijímají cholesterol ze „špatných“ buněk, poté jej transportují do jater k následnému zpracování na žlučové kyseliny. Popsaný proces je označován za jediný přirozený způsob odstranění cholesterolu z těla, proto se pro zdraví srdce a cév doporučuje vždy udržovat optimální hladinu HDL v krevní plazmě.
Lipoproteinové modifikace
Pro stanovení rizika rozvoje kardiovaskulárních onemocnění jsou důležité nejen samotné lipoproteiny, ale i jejich modifikované formy. Lipoproteiny mohou být modifikovány z normálních frakcí za vzniku patologických sloučenin. Hlavní důvody tohoto procesu jsou: uvolňování volných radikálů buňkami; zvýšená koncentrace glukózy v krvi; uvolňování produktů metabolismu lipidů do krve.
Níže jsou uvedeny nejvýznamnější modifikované lipoproteiny:
- Lipoprotein (a) je speciální typ lipoproteinu s nízkou hustotou, který se liší pouze některými strukturními znaky. Polypeptidový proteinový řetězec je tedy dodatečně připojen k lipoproteinové (a) buňce. To vede k tomu, že lipoproteiny (a) se selektivně začnou hromadit na stěnách cév a v nich se rozvíjí zánětlivý proces.
- Oxidovaný LDL. V důsledku vstupu velkého množství volných radikálů do krve dochází k oxidaci lipidů LDL membrán a vnášení produktů peroxidace lipidů do nich. Tento proces iniciuje vznik pěnových buněk, které se stávají stavebním materiálem aterosklerotických plátů.
- Glykovaný LDL. Když se glukóza naváže na lipoproteinové proteiny s nízkou hustotou, změní se jejich struktura. Jsou modifikovány a ve své nové struktuře jsou schopny setrvávat v krevním řečišti, kde podléhají dodatečné oxidaci a ukládají se na stěnách cév.
- Malý, hustý LDL. Patří do nejvýznamnější skupiny modifikovaných aterogenních sloučenin. Obsahují dostatečné množství cholesterolu a fosfolipidů, přičemž jejich struktura je podobná arteriálním buňkám. V důsledku složité biochemie se z mLDL uvolňují všechny fosfolipidy a cholesterol, které se následně ukládají na vaskulárním endotelu.
- Upravený HDL. Při syntéze HDL v jaterních buňkách se uvolňují některé sloučeniny s defekty, jejichž vlastnosti převádějí modifikovaný HDL z kategorie antiaterogenních do aterogenních.
Přítomnost těchto komplexů v krevní plazmě vede k narušení metabolismu tuků v těle, které je plné aterosklerotických změn v krevních cévách. Modifikované lipoproteiny lze rozpoznat pomocí podrobného lipidového profilu. Taková studie musí být provedena, pokud jsou v těle podezření na závažné příznaky, stejně jako s jejich dědičnými formami.
Hladiny v krvi
Nejdůležitějším způsobem stanovení rizika rozvoje kardiovaskulárních onemocnění je biochemie krve. Normy byly vypočteny pro každou lipoproteinovou frakci. Pokud je výsledek překročí nebo sníží, naznačuje to potřebu dalšího výzkumu k potvrzení existujících onemocnění. Normy lipoproteinů v krvi jsou uvedeny v následující tabulce:
Pro ženy mají tyto ukazatele své vlastní normy, které jsou spojeny s některými charakteristikami ženského těla. To může zahrnovat nižší tělesnou hmotnost, speciální hormonální pozadí (zejména obsah inhibinu B a folikuly stimulujícího hormonu v krvi) a odpovídající vlastnosti metabolických procesů v těle. Proto pro ženy bude taková tabulka vypadat takto:
Pokud se získané výsledky mírně liší od normy, pak nutriční korekce pomůže zabránit ateroskleróze a normalizovat metabolismus lipidů. V opačném případě může být zapotřebí seriózní léková terapie.
Bylo poznamenáno, že u žen během těhotenství, prvních 6 týdnů po porodu, perimenopauze a menopauze, se tyto ukazatele mohou výrazně lišit od normálních hodnot. Takové výsledky lze považovat za normální (s přihlédnutím k individuálním charakteristikám), pokud pacient nemá v anamnéze onemocnění jater, štítné žlázy, hypofýzy, ledvin a některých dalších orgánů.
Zvýšení aterogenních frakcí lipoproteinů (LDL, VLDL), stejně jako pokles lipoproteinů s vysokou hustotou u mužů a žen, může naznačovat přítomnost následujících onemocnění:
- ateroskleróza;
- angina pectoris;
- infarkt myokardu;
- jakýkoli typ hyperlipidemie;
- dědičná hyperlipidémie a hypercholesterolémie;
- narušení produkce hormonů štítné žlázy, a to jak ve směru nárůstu, tak ve směru poklesu;
- onemocnění hypofýzy;
- onemocnění ledvin (nefrotický syndrom, chronické selhání ledvin);
- onemocnění jater (chronické selhání jater, porfyrie, některé typy hepatitidy);
- onemocnění slinivky břišní, zejména pankreatitida a malignita;
- intoxikace alkoholem;
- obezita;
- metabolické patologie (například dna).
K potvrzení většiny uvedených patologií samotná biochemie krve nestačí, budou vyžadovány další diagnostické studie. Stojí za to pochopit, že některé stavy (například těhotenství) nebo užívání léků mohou ovlivnit výsledek biochemie krve. Proto by takové funkce měly být projednány se svým lékařem, protože by měly být uvedeny v doporučení pro krevní test. I když žena užívá antikoncepční pilulky, musí je buď na dva týdny vysadit, nebo tuto skutečnost uvést ve formuláři při podstoupení lipidového profilu.
Aterogenní a antiaterogenní frakce lipoproteinů
V posledních letech došlo k širokému rozšíření aterosklerózy, která je spojena především s rozvojem onemocnění hyperlipoproteinemií a hypercholesterolémií v organismu, které tento stav obvykle doprovází. Bylo zjištěno, že rozvoj aterosklerózy přímo souvisí se zvýšením hladiny aterogenních lipoproteinů - LDL a VLDL (to jsou nejvíce aterogenní lipidové sloučeniny). Současně se snižuje koncentrace lipoproteinů s vysokou hustotou, jediné antiaterogenní frakce lipoproteinů, v krevní plazmě.

Mezi aterogenní lipoproteiny patří také DILI, ale jejich koncentrace v krvi není v procesu hodnocení rizika aterosklerózy tak důležitá, protože tyto frakce jsou intermediárními lipidy.
Jak již bylo popsáno dříve, LDL frakce transportuje endogenní cholesterol do periferních tkání, HDL dělá opačnou práci - uvolňuje cholesterolové buňky z lipoproteinů s nízkou hustotou a tělesných buněk, poté je dopraví do jater k následnému zpracování na žluč a odstranění z tělo přirozeně. Z tohoto důvodu je optimální hladina antiaterogenních lipoproteinových frakcí tak důležitá pro metabolismus lipidů a prevenci tvorby aterosklerotických plátů na stěnách cév.
Pokud jde o chylomikrony, stojí za zmínku, že tyto komplexy samy o sobě nemají aterogenní vlastnosti. Jejich zbytkové složky však mohou být aterogenní.
Ke stanovení rizika rozvoje kardiovaskulárních onemocnění se používá koeficient aterogenity, který se vypočítá podle následujícího vzorce:
KA=(celkový cholesterol - HDL)/HDL.

Normálně by u mužů a žen měl být tento index v rozmezí 2-3 jednotek. Pokud je více než tři, znamená to vysoké riziko aterosklerózy. Pacienti s výsledkem větším než 5 by měli pochopit, že v jejich cévách již probíhají aterosklerotické procesy. Pokud je tento indikátor menší než dva, pak nejsou v těle pozorovány žádné zvláštní poruchy metabolismu lipidů, ale tento výsledek může být vyvolán některými dalšími onemocněními (například ledviny, játra).
Pro posouzení vašeho zdravotního stavu lékaři doporučují provádět biochemii krve ročně a její rozšířenou formu, kde se stanovují všechny lipoproteiny krevní plazmy, jednou za 5 let. To umožní včasné odhalení poruch metabolismu lipidů a přijetí vhodných opatření k prevenci rozvoje závažných onemocnění kardiovaskulárního systému.
LIPIDY jsou ve vodě nerozpustné sloučeniny, takže jejich transport v krvi vyžaduje speciální nosiče, které jsou rozpustné ve vodě. Takovými transportními formami jsou LIPOPROTEINY. Patří mezi volné LIPIDY. Syntetizovaný tuk ve střevní stěně, případně tuk syntetizovaný v jiných tkáních a orgánech, může být transportován krví až po zařazení do složení LIPOPROTEINŮ, kde bílkoviny hrají roli stabilizátoru.
Micely LIPOPROTEIN mají podle své struktury vnější vrstvu a jádro. Vnější vrstva je tvořena z PROTEINŮ, FOSFOLIPIDŮ a CHOLESTEROLU, které mají hydrofilní polární skupiny a vykazují afinitu k vodě. Jádro tvoří TRIGLYCERIDY, CHOLESTEROL ESTERY, IVF, vitamíny A, D, E, K.T.o. nerozpustné tuky se po syntéze ve střevní stěně i po syntéze v jiných tkáních mezi buňkami, které je syntetizují a využívají, snadno transportují do celého těla.
Existují 4 třídy krevních LIPOPROTEINŮ, které se od sebe liší chemickým stavem, velikostí micel a transportovanými tuky. Protože mají různou rychlost sedimentace v roztoku kuchyňské soli, dělí se na:
1. CHYLOMIKRONY. Tvoří se ve střevní stěně a mají největší velikost částic.
2. VLDL. Syntetizováno ve střevní stěně a játrech.
3. LDL. Tvoří se v endotelu kapilár z VLDL.
4. HDL. Tvoří se ve střevní stěně a játrech.
Že. transportní krevní lipidy jsou syntetizovány dvěma typy buněk – ENTEROCYTY a HEPATOCYTY. Bylo zjištěno, že krevní lipidy se při elektroforéze proteinů pohybují v zóně alfa a beta GLOBULINŮ, takže jejich elektroforetická pohyblivost je stále
označeno jako:
Pre-beta-LP = VLDL,
Beta-LP=LDL,
Alfa-LP = HDL.
rýže. Chemické složení krevních lipoproteinů
CHYLOMIKRONY (CM), jako největší částice při elektroforéze, zůstávají na začátku.
Jejich maximální koncentrace je dosaženo 4 - 6 hodin po jídle. Rozdělili se
působením enzymu - LIPOPROTEID LIPÁZY, který se tvoří v játrech, plicích a tukové tkáni
po příjmu potravy jsou CM transportovány převážně TRIacylGLYCERIDY (až 83 %).
VLDL a LDL transportují především cholesterol a jeho estery do buněk orgánů a tkání. Tyto frakce jsou klasifikovány jako ATEROGENNÍ. HDL bývá označován jako ANTI-ATEROGENNÍ LP, který transportuje CHOLESTEROL (přebytečný cholesterol uvolněný v důsledku rozpadu buněčných membrán) do jater k následné oxidaci za účasti cytochromu P450 za tvorby žlučových kyselin, které jsou vylučovány z tělo ve formě COPROSTEROLů. Krevní LIPOPROTEINY se po endocytóze rozkládají v LYSOZOMECH a MIKROZOMECH: působením LIPOPROTEID LIPÁZY v buňkách jater, ledvin, nadledvin, tukové tkáně střev, endotelu kapilár. Produkty hydrolýzy léčiv se podílejí na buněčném metabolismu.
Lipoproteiny se skládají z lipidů a proteinů. Jsou potřebné k transportu cholesterolu do buněk, které jej využívají. Nerovnováha v tomto systému vede k rozvoji závažných onemocnění.
Termín lipoproteiny označuje komplexní organické komplexy tvořené z lipidů a speciálních proteinů podílejících se na transportu hydrofobních molekul. Cholesterol, fosfolipidy, triglyceridy – všechny tyto látky patří mezi lipidy. To znamená, že se nerozpouštějí ve vodě, ale mohou se s ní za určitých podmínek pouze mísit a vytvářet emulze.
Lipoproteiny a lipoproteiny jsou synonyma, ale pojem lipoproteiny je častěji zmiňován ve vztahu k transportním formám volného cholesterolu a také jeho esterů. Protože se cholesterol podílí na syntéze životně důležitých hormonů a stavbě buněčných membrán, hraje významnou roli jeho dodávání do periferních tkání v těle.
Typy lipoproteinů se liší hustotou a nábojem na povrchu. Tyto vlastnosti určují jejich pohyblivost v elektromagnetickém poli a separaci na frakce při centrifugaci.Klinicky nejvýznamnější jsou tyto typy lipoproteinů:
- chylomikrony;
- pre-lipoproteiny;
- na lipoproteiny nebo beta;
- a lipoproteiny nebo alfa.
Každý z těchto typů se tvoří v tkáních a plní specifické funkce. Mají podobné složení, liší se však poměrem lipidů a bílkovin. Obecně je portrét jednotlivého lipoproteinu určen kvalitou proteinových molekul, díky čemuž je komplex rozpoznatelný pro různé buňky v těle.
V laboratorních studiích byly lipoproteiny poprvé rozděleny do frakcí centrifugací. Ukázalo se, že plíce jsou nahoře ve zkumavce a ty s větší hustotou dole. Odtud pocházejí další názvy, udávající hustotu jednotlivých zlomků.
Lipoproteiny s velmi nízkou hustotou se nazývají lehčí než voda. Z nich se tvoří lipoproteiny, patřící do frakce s nízkou hustotou, které si zaslouží označení „špatné“. A „dobré“ alfa lipoproteiny se nazývají vysokohustotní, jsou těžší než voda.
Při stanovení pravděpodobnosti rozvoje onemocnění srdce a cév se posuzuje celková hladina cholesterolu, frakce jednotlivých lipoproteinů a jejich poměr. Snížení počtu „špatných“ znamená snížení pravděpodobnosti infarktu nebo mrtvice.
Chylomikrony
Největšími a nejlehčími zástupci třídy lipoproteinů jsou chylomikrony, které se tvoří ve střevní stěně a slouží jako obal pro tuky dodávané s potravou. Velká velikost neumožňuje této frakci proniknout přímo do krve. Z tloušťky střevní stěny vstupují do celkového krevního oběhu, nejprve procházejí sítí lymfatických kapilár.
Složení chylomikronů obsahuje pouze 2 % bílkovin a 5 % cholesterolu s jeho estery. Jsou lehčí než voda, protože jsou nabité triacylglyceridy, jinými slovy tuky. Po jídle začnou chylomikrony vstupovat do krevní plazmy, což jí dodává opalescentní vzhled
mléko. Několik hodin dělají svou práci a dodávají lipidové molekuly do buněk, které to potřebují.
Při vyšetření pacientů biochemický krevní test hodnotí množství triacylglyceridů nesených chylomikrony. Méně než 12 hodin po posledním jídle budou naměřené hodnoty zvýšené a nepřesné. Analýza se provádí nalačno. U zdravých lidí po 12–14 hodinách hladovění nejsou v krevní plazmě žádné chylomikrony.
Norma triacylglyceridů u mužů je 0,45–1,81 mmol/l, u žen je norma 0,40–0,53 mmol/l. Hodnoty se u mužů a žen liší vlivem pohlavních hormonů.
Lipoproteiny s velmi nízkou hustotou
Tato třída lipoproteinů dosud neobdržela jednoznačné hodnocení ze strany lékařské veřejnosti. Jejich role v rozvoji aterosklerózy nebyla spolehlivě stanovena a nebyla stanovena optimální hladina pro muže a ženy. Jejich množství v těle se zvyšuje u lidí, kteří zneužívají alkohol.
Tvoří se v játrech a slouží jako transportní forma pro endogenní cholesterol. Vlivem enzymů v krevní plazmě se z nich přenosem bílkovin z lipoproteinu a tvoří lipoproteiny.
Beta lipoproteiny
Lipoproteiny s nízkou hustotou si vysloužily označení „špatné“ pro svou vysokou aterogenitu. Jejich složení zahrnuje 55 % cholesterolu, ale pouze 22 % bílkovin. Asi 70 % veškerého cholesterolu v těle se přenáší na lipoproteiny a to je hlavní transportní forma pro dodávání cholesterolu do tkání. Bez této funkce, kterou plní lipoproteiny, je životně důležitá syntéza buněčných membrán a steroidních hormonů nemožná.
Beta lipoproteiny v krvi se tvoří z lipoproteinů o velmi nízké hustotě působením enzymu lipoprotein lipázy. Jediný typ proteinu obsažený v jejich složení je charakteristický znak, který umožňuje buňkám rozpoznat tento komplex a zachytit ho z krve. Na této funkci přímo závisí obnova buněčných membrán, syntéza vitaminu D a steroidních hormonů.
Buňky zachycují lipoproteiny z krve interakcí s proteinem, který tvoří komplex s lipidy. Počet receptorů v těle není konstantní a závisí na působení hormonů.
To vysvětluje, proč ateroskleróza často komplikuje průběh některých onemocnění endokrinního systému, takže je třeba je omezit.
Počet receptorů se zvyšuje pod vlivem inzulínu a hormonů štítné žlázy. U pacientů s diabetem nebo hypotyreózou jsou beta lipoproteiny často zvýšené, stejně jako riziko rozvoje srdečních příhod. Pacienti by měli přísně dodržovat dietu, snížit množství sacharidů a užívat léky.
Pokud je hladina steroidních hormonů zvýšená, zvyšuje se tím i riziko aterosklerózy. Hormony kůry nadledvin mohou snižovat tvorbu receptorů. U žen ve fertilním věku jsou díky estrogenům zřídka zvýšené „špatné“ lipoproteiny.
Norma pro lipoproteiny s nízkou hustotou pro muže a ženy není vyšší než 3,36 mmol / l.
Alfa lipoproteiny
Lipoprotein a plní dvě hlavní funkce: transportuje cholesterol z tkání do jater a dodává molekuly bílkovin dalším lipoproteinům. Obsahují 50 % bílkovin a asi 20 % cholesterolu. Jaterní buňky a střevní stěna syntetizují nezralé alfa-lipoproteiny, pod vlivem enzymů krevní plazmy se mění počet proteinových a lipidových molekul, které tvoří kompletní komplex.
 Alfa lipoproteiny jsou těžší než voda a nejrychleji se pohybují v elektrickém poli. Norma pro lipoprotein a pro muže a ženy je 0,92–1,95 mmol/l.
Alfa lipoproteiny jsou těžší než voda a nejrychleji se pohybují v elektrickém poli. Norma pro lipoprotein a pro muže a ženy je 0,92–1,95 mmol/l.
Dyslipoproteinémie
Komplexní dynamický proces výměny lipidů a proteinů mezi různými třídami lipoproteinů probíhá nepřetržitě. Narušení těchto procesů se projevuje nerovnováhou, kdy jsou některé látky zvýšené, snížené nebo chybí. Dyslipoproteinémie může být dědičná nebo sekundární, doprovázející poruchy endokrinního systému a metabolismu.
Familiární hyperlipoproteinémie
Genetické abnormality kteréhokoli z proteinů, které tvoří lipoproteinové komplexy, vedou k rozvoji závažných patologií. Defektní geny neovlivňují pohlavní chromozomy, nemoci postihují muže i ženy stejně.
Hladiny triacylglyceridů a cholesterolu v krvi jsou zvýšené. Paměť lidí se brzy zhoršuje, kvůli zúžení průsvitu cév se objevují silné bolesti břicha, narušují se funkce slinivky břišní.
Příznaky koronární insuficience se začínají objevovat v dospívání. Pacienti jsou ohroženi rozvojem časného, před 30. rokem věku, infarktu myokardu. Riziko lze snížit přísným dodržováním diety s omezením tuků a užíváním statinů.
Akantocytóza
Defekt v genu kódujícím tvorbu jednoho proteinu „špatných“ lipoproteinů vede k rozvoji akantocytózy. Nemoc je dědičná bez ohledu na pohlaví a vyskytuje se u mužů i žen.
Při redukci lipoproteinů je narušen transport cholesterolu, nezbytného pro stavbu membrán, buněk nervového systému a krve. V důsledku poškození myelinových pochev neuronů dochází k neurologickým poruchám a zhoršenému vidění. Zkracuje se životnost červených krvinek a rozvíjí se anémie.
Tuky z potravy tělo nevstřebává, hromadí se v játrech a střevech a vzniká nedostatek vitamínů rozpustných v tucích. Pacientům se doporučuje jíst dietu s omezeným obsahem živočišných tuků a užívat velké dávky vitamínu E.
Modifikované lipoproteiny
K modifikacím lipoproteinů dochází, když jsou vystaveny určitým enzymům, protilátkám, produktům peroxidace nebo glukóze. Tento vliv mění vlastnosti molekul bílkovin a s nimi i metabolické dráhy. Nejvíce aterogenní jsou modifikované lipoproteiny. Usazují se na stěnách tepen, poškozují je a tvoří aterosklerotické pláty.
Když je hladina glukózy v krvi zvýšená, její připojení k lipoproteinovým komplexům narušuje jejich normální metabolismus. To vysvětluje dřívější rozvoj aterosklerózy u lidí s cukrovkou.
Hlavními lipidy v lidské krevní plazmě jsou triglyceridy, fosfolipidy a cholesterylestery. Tyto sloučeniny jsou estery mastných kyselin s dlouhým řetězcem a jako lipidová složka jsou společně zahrnuty do složení lipoproteinů. Tlustý
kyseliny jsou také přítomny v plazmě ve volné (neesterifikované) formě.
Úložištěm mastných kyselin je tuková tkáň a jsou využívány v játrech a svalech, kam jsou transportovány ve formě volných mastných kyselin (FFA). Mastné kyseliny, zejména kyselina palmitová, olejová a linolová, se ukládají v tukové tkáni ve formě triglyceridů. Rychlost mobilizace triglyceridů je dána prací hormonálně senzitivní lipázy, jejíž aktivita se zvyšuje pod vlivem některých hormonů, jako je norepinefrin a glukokortikoidy. Lipolýza vede k uvolňování mastných kyselin a glycerolu do plazmy a zvyšuje se za podmínek akutního stresu, dlouhodobého hladovění a nedostatku inzulínu.
Triglyceridy (nebo triacylglyceridy) jsou estery mastných kyselin a glycerolu. K syntéze triglyceridů v játrech a tukové tkáni dochází cestou glycerofosfátu, zatímco v tenkém střevě triglyceridy vznikají hlavně díky přímé esterifikaci monoglyceridů absorbovaných z potravy. Triglyceridy resyntetizované v buňkách tenkého střeva se uvolňují do střevních lymfatických cév ve formě chylomikronů a poté se dostávají do krevního řečiště přes hrudní lymfatický kanál. Normálně je absorbováno více než 90 % triglyceridů. To znamená, že denně se do krve dostane 70-150 g exogenních triglyceridů. V tenkém střevě dochází k tvorbě tzv. endogenních triglyceridů, které jsou syntetizovány z endogenních mastných kyselin, ale jejich hlavním zdrojem jsou játra, odkud jsou vylučovány ve formě lipoproteinů s velmi nízkou hustotou (VLDL). Rozsah zbytků mastných kyselin nalezených v triglyceridech a VLDL závisí do značné míry na složení triglyceridových mastných kyselin dodávaných ve stravě.
Dva hlavní fosfolipidy, které jsou přítomny v plazmě, jsou fosfatidylcholin (lecitin) a sfingomyelin. K syntéze fosfolipidů dochází téměř ve všech tkáních, ale hlavním zdrojem plazmatických fosfolipidů jsou játra. Fosfolipidy jsou nedílnou součástí všech buněčných membrán. Mezi plazmou a červenými krvinkami probíhá neustálá výměna lecitinu a sfingomyelinu. Oba tyto fosfolipidy jsou přítomny v plazmě jako složky lipoproteinů, kde hrají klíčovou roli při udržování rozpustného stavu nepolárních lipidů, jako jsou triglyceridy a cholesterylestery.
Cholesterol je sterol obsahující steroidní jádro se čtyřmi kruhy a hydroxylovou skupinu. Tato sloučenina se v těle nachází jak jako volný sterol, tak jako ester s jednou z mastných kyselin s dlouhým řetězcem. Volný cholesterol -
součást všech buněčných membrán a hlavní forma, ve které je cholesterol přítomen ve většině tkání. Výjimkou je kůra nadledvin, plazma a ateromatózní pláty, kde převažují estery cholesterolu. Většina tkání má schopnost syntetizovat cholesterol, ale normálně je téměř všechen cholesterol syntetizován v játrech a distálním tenkém střevě.
Raným krokem syntézy cholesterolu je přeměna acetátu na kyselinu mevalonovou. Enzym, který určuje rychlost tohoto procesu, se nazývá 3-hydroxy-3-methylglutaryl-coenim A reduktáza (HMG-CoA reduktáza). Aktivita tohoto enzymu je regulována na principu zpětné vazby konečným produktem reakce, cholesterolem. Hlavními metabolity cholesterolu jsou žlučové kyseliny,
- syntetizován výhradně v játrech. Klíčovým enzymem je v tomto případě cholesterol-7-alfa-hydroxyláza.
Více než dvě třetiny cholesterolu v plazmě jsou esterifikovány především kyselinou linolovou a olejovou. Tyto estery vznikají především v plazmě působením enzymu lecitin-cholesterolacyl-transferázy (LCAT). Poměrně malý podíl na tomto procesu má také enzym tenkého střeva a jater - ACAT. Povaha esterů cholesterolu závisí do značné míry na mastných kyselinách
složení plazmatického lecitinu nebo jinými slovy na typu tuku v potravině. Na rozdíl od svých esterů se volný plazmatický cholesterol snadno vyměňuje s cholesterolem buněčné membrány.
Běžně se hladina celkového cholesterolu (TC) v krevní plazmě pohybuje od 4 do 6,5 mmol/l, ale na rozdíl od hladiny triglyceridů se po konzumaci tučných jídel prudce nezvyšuje.
Všechny lipidy, s výjimkou volných mastných kyselin, vstupují do plazmy ve formě makromolekulárních komplexů zvaných lipoproteiny. Tyto komplexy obsahují specifické proteinové složky, apolipoproteiny (apoproteiny nebo jednoduše apo), které interagují s fosfolipidy a volným cholesterolem a tvoří polární vnější obal, který chrání nepolární triglyceridy a cholesterylestery umístěné uvnitř.
Pomocí ultracentrifugace krevní plazmy odebrané dárci po jídle lze rozlišit šest tříd lipoproteinů. Všechny jsou to sférické částice různé velikosti a sestávající ze směsi proteinů, fosfolipidů, triglyceridů, volného a esterifikovaného cholesterolu, jejichž relativní množství se mezi různými třídami lipoproteinů liší. Převážná část cholesterolu se tedy nachází v lipoproteinech s nízkou hustotou (LDL) a výrazně menší část se nachází ve VLDL a lipoproteinech s vysokou hustotou (HDL). Na rozdíl od cholesterolu jsou endogenní triglyceridy transportovány primárně jako součást VLDL. Chylomikrony slouží k transportu triglyceridů v prvních hodinách po jídle a za normálních okolností zcela zmizí z plazmy po 12 hodinách hladovění. Měření celkového cholesterolu a triglyceridů v plazmě nebo séru tedy poskytuje součet příspěvků každé třídy lipoproteinů. Změny hladin lipidů v séru obvykle odrážejí změny buď v koncentracích lipoproteinů, nebo v poměru hladin různých tříd lipoproteinů. Normálně je koncentrace zbytkových částic neboli lipoproteinů střední hustoty (IDL) v plazmě relativně nízká a jejich přínos je zpravidla zanedbáván, ale může být rozhodující při měření cholesterolu a triglyceridů v krvi pacientů s některými formami hyperlipidemie.
Před popisem metabolismu různých tříd lipoproteinů je nutné provést stručný přehled fyzikálních vlastností jak těchto částic samotných, tak apolipoproteinů, které je obsahují. Plazmové liporoproteiny se liší rychlostí flotace, hydratovanou hustotou, velikostí a elektroforetickou pohyblivostí. V současnosti je nejběžnější klasifikace lipoproteinů založena na rozdílech v jejich hustotě, která se používá k separaci těchto částic ultracentrifugací. Kromě toho jsou lipoproteiny
Významně se liší také obsahem apolipoproteinů, neboli apoproteinů.
Apoproteiny plní tři hlavní funkce: 1) interagují s fosfolipidy, pomáhají solubilizovat estery cholesterolu a triglyceridy; 2) regulovat reakce lipoproteinových lipidů s enzymy, jako je LCAT, lipoproteinová lipáza a jaterní lipáza; 3) vázat se na receptory na povrchu buněk a tím určovat místa záchytu a rychlost degradace dalších složek, zejména cholesterolu. K vazbě apoproteinů na lipidy dochází primárně prostřednictvím hydrofobních interakcí mezi řetězci mastných kyselin fosfolipidů a nepolárními oblastmi apoproteinů. Iontové interakce mezi polárními skupinami fosfolipidových hlav a páry opačně nabitých aminokyselin apoproteinů hrají sekundární stabilizační roli.
Apolipoproteiny rodiny A, apo A-I a apo A-II, jsou hlavními proteinovými složkami HDL. Existují důkazy, že když jsou oba apoproteiny A blízko u sebe, jako je tomu v případě HDL, apo A-II zesiluje vlastnosti apo A-I vázat lipidy. Další funkcí apo A-I je aktivace enzymu LCAT
Apoprotein B nebo apo B je charakterizován heterogenitou a variacemi v molekulové hmotnosti; apo BSO0 se nachází hlavně v chylomikronech, VLDL a LDL, a apo B48 se nachází pouze v chylomikronech. V tomto případě apo BSO0 slouží jako ligand pro LDL receptor, ale apo B48 nikoliv.
Apoprotein C zahrnuje alespoň tři jednotlivé apoproteiny, které jsou hlavními složkami VLDL a vedlejší složkou HDL. Předpokládá se, že apo C-II aktivuje enzym lipoprotein lipázu.
Apoprotein E, složka VLDL, LPPP a HDL, vstupuje do plazmy především jako součást nově syntetizovaného HDL. Apo E vykonává několik funkcí, včetně receptorem zprostředkovaného přenosu cholesterolu mezi tkáněmi a plazmou.
Další apoproteiny zahrnují apo D, minoritní složku HDL; apo A-IV, nalezený ve střevních chylomikronech; stejně jako apo(a), jedna z proteinových složek speciálního lipoproteinu (a) nebo LP(a). V současné době literatura obsahuje podrobné přehledy moderních dat o struktuře a funkcích apolipoproteinů.
Lipoproteiny jednotlivých tříd hrají v aterogenezi různou roli, a proto je nutné uvést jejich stručný popis.
Chylomikrony jsou největší lipoproteinové částice, mají průměr od 100 do 1000 nm a obsahují převážně triglyceridy
dy, dále malé množství fosfolipidů, volného cholesterolu, jeho esterů a bílkovin. Hlavní funkcí chylomikronů je transport dietních triglyceridů ze střeva, kde jsou absorbovány, do krevního řečiště.
VLDL (pre-β-lipoproteiny) mají podobnou strukturu a složení jako chylomikrony, ale jsou menší velikosti, od 25 do 100 nm, a obsahují méně triglyceridů, ale více cholesterolu, fosfolipidů a bílkovin. VLDL se od chylomikronů liší místem syntézy a zdrojem transportovaných triglyceridů. VLDL se tedy tvoří hlavně v játrech a slouží k transportu endogenních triglyceridů.
Rychlost tvorby VLDL se zvyšuje se zvýšením toku volných mastných kyselin vstupujících do jater, stejně jako v situacích, kdy se zvyšuje rychlost syntézy endogenních mastných kyselin v játrech, k čemuž dochází, když do těla vstupuje velké množství sacharidů. .
VLDL částice se liší velikostí. V důsledku lipolýzy vznikají malé VLDL – nazývají se remnantní VLDL nebo lipoproteiny střední hustoty (IDL), které jsou meziproduktem procesu přeměny VLDL na LDL. Při hypertriglyceridémii dochází nejen k nárůstu počtu, ale i velikosti VLDL, což může být pravděpodobně příčinou dalšího charakteristického znaku tohoto onemocnění – snížení hladiny LDL.
LDL f-lipoproteiny) jsou hlavní třídou plazmatických lipoproteinů, které transportují cholesterol. Tyto částice se liší od svých prekurzorů VLDL tím, že mají významně nižší obsah triglyceridů a přítomnost pouze jednoho apo B100 z řady apoproteinů nalezených ve VLDL. Katabolismus LDL závisí jak na faktorech prostředí, například na typu konzumovaného tuku, tak na genetických faktorech, jako jsou mutace v genech kódujících receptor LDL a apo B.
HDL (a-lipoproteiny) se dělí na podtřídy HDL2 a HDL3 na základě rozsahu jejich hustoty. Více než 90 % HDL proteinu je zastoupeno proteinem apo A. HDL je syntetizován v játrech a tenkém střevě. Akumulace cholesterylesterů v retikuloendoteliálním systému pacientů, kteří postrádají HDL (Tangierova choroba) naznačuje, že HDL normálně hraje vedoucí roli při odstraňování tkáňového cholesterolu.
LP (a) je větší než LDL, ale má ve srovnání s nimi vyšší hustotu a má elektroforetickou pohyblivost charakteristickou pro VLDL. Lipoprotein (a) se z hlediska lipidového složení neliší od LDL, ale má více bílkovin včetně vlastního apo (a) - dle
lymorfní protein, který má vysoký stupeň homologie s plazminogenem a obsahuje větší množství sacharidů. Existují důkazy, že lipoprotein(a) se tvoří výhradně v játrech, bez ohledu na metabolismus VLDL.
Metabolismus lipoproteinů je komplexní dynamický a do značné míry neprobádaný proces, který zahrnuje jak různé pohyby lipidů a apoproteinů mezi jednotlivými třídami lipoproteinů, tak řadu reakcí katalyzovaných enzymy. Tyto interakce vedou mimo jiné k receptorově zprostředkovanému vstupu cholesterolu do buňky nebo k jeho odstranění z buňky.
Zde je vhodné připomenout, že funkce apoproteinů není omezena pouze na to, že tvoří s lipidy rozpustné, a tedy krví přenosné komplexy. Bylo zjištěno, že některé apoproteiny plní koenzymovou roli, aktivující určité reakce metabolismu lipidů. Konkrétně apo A-I aktivuje reakci prováděnou LCAT.Při této reakci, jak je známo, dochází k esterifikaci volného cholesterolu v krevní plazmě. Existují důkazy, že reakce LCAT je také katalyzována apo C-I.
Apo C-II se ukázalo být nezbytnou složkou pro reakce katalyzované lipoproteinovými lipázami. Vzhledem k tomu, že působením lipoproteinové lipázy dochází k rozkladu triglyceridů chylomikronů a VLDL, nabývá tato reakce zvláštní důležitosti jako počáteční krok v katabolismu těchto lipoproteinů.
V roce 1985 byli američtí vědci J. Goldstein a M. Brown oceněni Nobelovou cenou za objev LDL receptoru a stanovení příčiny familiární hypercholesterolémie. Zjistili, že hlavní úlohou LDL receptoru je poskytnout všem buňkám těla dostupný zdroj cholesterolu, který je nezbytný pro syntézu buněčných membrán, a některé orgány ho také využívají jako substrát pro tvorbu určitých produktů. jejich metabolismu, například žlučové kyseliny, pohlavní hormony, kortikosteroidy. Proto buňky jater, gonád a nadledvin obsahují velké množství LDL receptorů. Játra jsou díky své velikosti hlavním místem receptorem zprostředkovaného katabolismu LDL. LDL receptory také vážou zbytek VLDL (nebo LDLP) a jednu z podtříd HDL, která má protein apo-E.
Koordinovaná regulace exprese LDL receptoru a aktivity HMG-CoA reduktázy zajišťuje fungování homeostatického mechanismu dodávání cholesterolu do buněk, jako jsou hepatocyty, které ho denně zpracovávají velké množství. Farmakologická činidla, která kompetitivně inhibují HMG-CoA-re-
duktázy, blokují endogenní syntézu cholesterolu a tím stimulují expresi LDL receptoru, což vede ke snížení hladiny LDL cholesterolu v krevní plazmě.
HDL receptor byl identifikován v kultivovaných fibroblastech a buňkách hladkého svalstva. Exprese tohoto receptoru se zvyšuje, když jsou buňky zatíženy cholesterolem. Kromě toho byly popsány dva další lipoproteinové receptory, ačkoli jejich příspěvek k metabolismu lipoproteinů in vivo nebyl stanoven.
Ve zjednodušené formě může být intracelulární a tkáňový metabolismus lipoproteinů různých tříd znázorněn následovně. Chylomikrony dodávají lipidy z potravy do krevní plazmy prostřednictvím lymfy. Vlivem extrahepatální lipoproteinové lipázy, aktivované a-po C-II, dochází k přeměně chylomikronů v plazmě na zbytky, které jsou zachyceny hepatocytovými receptory, které rozpoznávají povrchový apo-E. Endogenní triglyceridy jsou přenášeny VLDL z jater do plazmy, kde stejně jako chylomikrony podléhají částečné degradaci na zbytkový VLDL neboli RLD. Na druhé straně je DILI buď zachyceno LDL receptory, které rozpoznávají apo E nebo apo BSO, nebo je přeměněno na LDL obsahující apo BSO, ale již nemá apo E. V tomto procesu se může účastnit jaterní lipáza. K katabolismu LDL dochází dvěma hlavními způsoby, z nichž jeden je spojen s receptory LDL a druhý s jaterní triglycerid lipázou. HDL má komplexní původ: jeho lipidová složka zahrnuje buď volný cholesterol a fosfolipidy uvolněné při lipolýze chylomikronů a VLDL, nebo volný cholesterol pocházející z periferních buněk, zatímco hlavní apoprotein HDL, apo A-I, je syntetizován jak v játrech, tak v tenké střevo. Nově syntetizované částice HDL v plazmě jsou reprezentovány podtřídou HDL3, ale nakonec se vlivem LCAT aktivovaného apo A-I přemění na HDL2. Bohužel zatím nemáme přesné údaje o sekvenci skládání lipoproteinových částic, o mechanismech tohoto procesu nemluvě.
Tabulka 1.1
Rozsah kolísání obsahu celkového cholesterolu (TC), triglyceridů (TG), LDL-C a HDL-C v krevní plazmě (v mmol/l) je normální.
|
Věk, roky |
HCO |
TG |
LDL-C |
HDL-C |
|
0-19 |
3.2-5.2 |
0.4-1.5 |
1.7-3.4 |
1.0-1.9 |
|
20-29 |
3.2-5.9 |
0.5-2.1 |
1.8-4.3 |
0.8-1.7 |
|
30-39 |
3.7-6.8 |
0.6-3.2 |
2.1-4.9 |
0.8-1.7 |
|
40-49 |
4.0-7.0 |
0.6-3.5 |
2.3-5.0 |
0.8-1.7 |
|
50-59 |
4.1-7.2 |
0.7-3.3 |
2.3-5.2 |
0.8-1.7 |
Složení, struktura a klasifikace krevních lipoproteinů. Úloha různých tříd lipoproteinů v patogenezi hyperlipoproteinémie. Doplnil: Khapez A.E. Skupina: 218 b Západokazašská státní lékařská univerzita pojmenovaná po Maratu Ospanovovi Nezávislá studentská práce
Relevance plánu 1. Složení, struktura, klasifikace a fyziologická úloha krevních lipoproteinů. 2. Tvorba chylomikronů a transport tuků. 3. Úloha různých tříd lipoproteinů v těle a patogeneze hyperlipoproteinémie. 4. Biochemie aterosklerózy. 5. Poruchy metabolismu cholesterolu. Závěr Seznam referencí

Význam Vysoké hladiny lipoproteinů v krevní plazmě jsou rizikovým faktorem pro koronární srdeční onemocnění, aterosklerózu, trombózu a mrtvici. Vysoká hladina lipoproteinu, stejně jako vysoká hladina LDL, určuje riziko rozvoje časné aterosklerózy. Studium základních vlastností lipoproteinů umožní přesnější diagnostiku těchto onemocnění, pomůže také při jejich prevenci a léčbě.

Složení a struktura lipoproteinů krevní plazmy Lipoproteiny jsou komplexy lipidů s proteiny. Všechny typy lipoproteinů mají podobnou strukturu – hydrofobní jádro a hydrofilní vrstvu na povrchu. Hydrofilní vrstvu tvoří proteiny zvané apoproteiny a amfifilní molekuly lipidů – fosfolipidy a cholesterol. Hydrofilní skupiny těchto molekul jsou obráceny k vodné fázi a hydrofobní části jsou obráceny k hydrofobnímu jádru lipoproteinu, který obsahuje transportované lipidy.

Klasifikace lipoproteinů krevní plazmy Lipoproteiny krevní plazmy jsou klasifikovány podle jejich hustoty: chylomikrony (CM) lipoproteiny s velmi nízkou hustotou (VLDL) lipoproteiny se střední hustotou (IDL) lipoproteiny s nízkou hustotou (LDL) lipoproteiny s vysokou hustotou (HDL)



Fyziologická úloha lipoproteinů krevní plazmy Apoproteiny ve složení lipoproteinů plní nejen funkci strukturní, ale zajišťují i aktivní účast lipidových komplexů na transportu lipidů v krevním řečišti z míst jejich syntézy do buněk periferních tkání, jako např. stejně jako zpětný transport cholesterolu do jater pro další metabolické přeměny. Apoproteiny působí jako ligandy při interakci léčiv se specifickými receptory na buněčných membránách, čímž regulují homeostázu cholesterolu v buňkách a v těle jako celku. Neméně důležitá je regulace apoproteiny aktivity řady základních enzymů metabolismu lipidů: lecitin-cholesterol acyltransferázy, lipoproteinové lipázy, jaterní triglyceridové lipázy.

Tvorba chylomikronů Hlavním apoproteinem ve složení KM je protein apoB-48. Tento protein je kódován ve stejném genu jako protein VLDL – B-100, který je syntetizován v játrech. Protein apoB-48 je syntetizován v drsném ER a je tam glykosylován. Poté v Golgiho aparátu dochází k tvorbě CM, nazývaných „nezralé“. Mechanismem exocytózy se vylučují do chylu, který se tvoří v lymfatickém systému střevních klků, a hlavním hrudním mízním kanálkem se dostávají do krve. V lymfě a krvi se apoproteiny E (apoE) a C-P (apoS-P) přenášejí z HDL do CM; XM se promění v „zralé“.

Transport tuků chylomikrony V krvi jsou triacylglyceroly, které jsou součástí zralých KM, hydrolyzovány enzymem lipoprotein lipázou neboli LP lipázou. LP lipáza hydrolyzuje molekuly tuku na glycerol a 3 molekuly mastných kyselin. V důsledku působení LP lipázy na CM tuky vznikají mastné kyseliny a glycerol. Většina mastných kyselin proniká do tkání. V tukové tkáni se v období vstřebávání ukládají mastné kyseliny ve formě triacylglycerolů, v srdečním svalu a pracujících kosterních svalech jsou využívány jako zdroj energie. Další produkt hydrolýzy tuků, glycerol, je rozpustný v krvi a je transportován do jater, kde může být během doby vstřebávání využit pro syntézu tuků.


Úloha různých tříd lipoproteinů v těle a patogeneze hyperlipoproteinémie Hyperhypoproteinémie (HLP) je zvýšení určité třídy nebo tříd lipoproteinů v krvi. Podle verze WHO se rozlišují následující typy SLP. Typ I – hyperchylomikronemie. Hlavní změny jsou následující: vysoký obsah CM, normální nebo mírně zvýšený obsah VLDL; prudce zvýšené hladiny triglyceridů v krevním séru. Klinicky se tento stav projevuje xantomatózou. Typ II se dělí na dva podtypy: typ IIa - hyper-β-hypoproteinémie s charakteristickým vysokým obsahem LDL v krvi a typ IIb - hyper-β-lipoproteinémie s vysokým obsahem dvou tříd lipoproteinů současně (LDL, VLDL) . U typu II je vysoký a v některých případech velmi vysoký obsah cholesterolu v krevní plazmě. Hladina triglyceridů v krvi může být buď normální (typ aIIa) nebo zvýšená (typ IIb). Klinicky se projevuje aterosklerotickými poruchami, často se rozvíjí ischemická choroba srdeční (ICHS).

Úloha různých tříd lipoproteinů v těle a patogeneze hyperlipoproteinémie Typ III – tis-β-hypoproteinémie. V krevním séru se objevují lipoproteiny s neobvykle vysokým obsahem cholesterolu a vysokou elektroforetickou pohyblivostí („plovoucí“ β-lipoproteiny). Hromadí se v krvi v důsledku porušení přeměny VLDL na LDL. Tento typ HLP se často kombinuje s různými projevy aterosklerózy, včetně onemocnění koronárních tepen a poškození cév nohou. Typ IV – hyperpre-β-hypoproteinémie. Charakterizováno zvýšením hladin VLDL, normálními hladinami LDL a absencí CM; zvýšené hladiny triglyceridů s normálními nebo mírně zvýšenými hladinami cholesterolu. Klinicky se tento typ kombinuje s cukrovkou, obezitou a ischemickou chorobou srdeční. Typ V – hyperpre-β-hypoproteinémie a hyperchylomikronemie. Je pozorováno zvýšení hladin VLDL a přítomnost CM. Klinicky se projevuje xantomatózou, někdy kombinovanou s latentním diabetem. Koronární srdeční onemocnění není u tohoto typu HLP pozorováno.

Biochemie aterosklerózy Jednou z hlavních příčin rozvoje aterosklerózy je nerovnováha mezi příjmem cholesterolu z potravy, jeho syntézou a vylučováním z těla. 1. fáze Proces začíná poškozením vaskulárního endotelu v důsledku změněné struktury LDL. Poškození je způsobeno volnými radikály, které vznikají během metabolismu nebo přicházejí zvenčí. U LDL se mění nejen struktura samotných lipidů, ale narušuje se i struktura apoproteinů. Oxidovaný LDL je vychytáván makrofágy prostřednictvím scavengerových receptorů. Tento proces není regulován množstvím absorbovaného cholesterolu, jako v případě jeho vstupu do buněk přes specifické receptory, takže makrofágy jsou přetíženy cholesterolem a mění se v „pěnové buňky“, které pronikají do subendoteliálního prostoru. To vede k tvorbě tukových pruhů ve stěně cév.

Biochemie aterosklerózy Stádium 2 V tomto stádiu si vaskulární endotel může udržet svou strukturu. Jak se počet „pěnových buněk“ zvyšuje, dochází k poškození vaskulárního endotelu. Normálně endoteliální buňky vylučují prostaglandin I 2 (prostacyklin I 2), který inhibuje agregaci krevních destiček. Při poškození endoteliálních buněk dochází k aktivaci krevních destiček. Za prvé vylučují tromboxan A2, který stimuluje agregaci krevních destiček, což může vést k tvorbě krevní sraženiny v oblasti aterosklerotického plátu; za druhé, krevní destičky začnou produkovat peptid - růstový faktor odvozený od krevních destiček, který stimuluje proliferaci SMC. SMC migrují z mediální vrstvy do vnitřní vrstvy arteriální stěny a přispívají tak k růstu plaku.

Biochemie aterosklerózy Stupeň 3 Dále plak roste s vazivovou tkání (kolagen, elastin); buňky pod vazivovou membránou nekrotizují a cholesterol se ukládá v mezibuněčném prostoru. V této fázi se ve středu plaku tvoří dokonce i krystaly cholesterolu. Fáze 4 Plak je nasycen vápenatými solemi a stává se velmi hustým. V oblasti plaku se často tvoří krevní sraženiny, které blokují lumen cévy, což vede k akutním poruchám krevního oběhu v odpovídající oblasti tkáně a rozvoji srdečního infarktu. Nejčastěji se aterosklerotické pláty vyvíjejí v tepnách myokardu, takže nejčastějším onemocněním, které vzniká v důsledku aterosklerózy, je infarkt myokardu.

Poruchy metabolismu cholesterolu Hypercholesterolémie je přebytek normální koncentrace cholesterolu v krvi. Hypercholesterolémie se často vyvíjí v důsledku nadměrného příjmu cholesterolu z potravy, stejně jako sacharidů a tuků. Hyperkalorická výživa je jedním ze společných faktorů rozvoje hypercholesterolémie, protože pouze acetyl-CoA, ATP a NADPH jsou nezbytné pro syntézu cholesterolu. Všechny tyto substráty vznikají při oxidaci glukózy a mastných kyselin, takže nadměrný příjem těchto složek potravy přispívá k rozvoji hypercholesterolémie. Normálně příjem cholesterolu z potravy snižuje syntézu vlastního cholesterolu v játrech, ale s věkem se účinnost regulace u mnoha lidí snižuje.

Poruchy metabolismu cholesterolu Jakýkoli defekt LDL receptoru nebo proteinu apoB-100, který s ním interaguje, vede k rozvoji nejčastějšího dědičného onemocnění – familiární hypercholesterolémie. Toto autozomálně dominantní onemocnění je způsobeno mutacemi v genu LDL receptoru. Heterozygoti, kteří mají jeden normální gen a druhý defektní, se vyskytují s frekvencí 1:500 lidí. Homozygoti jsou vzácní - 1: člověk. Koncentrace cholesterolu a LDL v krvi těchto pacientů již v raném dětství jsou zvýšeny 5-6krát. LDL je vychytáván makrofágy prostřednictvím fagocytózy. Makrofágy, zatížené přebytkem cholesterolu a dalších ligandů obsažených v LDL, se ukládají v kůži a dokonce i ve šlachách a tvoří tzv. xantomy. Cholesterol se také ukládá ve stěnách tepen a tvoří aterosklerotické pláty. Takové děti bez mimořádných léčebných opatření umírají ve věku 5-6 let.


Seznam použité literatury: 1. Komarov F.I., Korovkin B.F. a Menshikov V.V. Biochemický výzkum na klinice, str. 407, L., Metzler D. Biochemistry, přel. z angličtiny, díl 2, M., Nikolaev A.Ya. Biologická chemie, M., Biochemie: Učebnice. pro univerzity, Ed. E.S. Severina, 2003