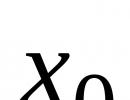Okluze srdečních cév. Nemoci, syndromy koronárních tepen a jejich léčba. Proces vzniku okluze
Je dobře známo, že ze všech morfologických forem aterosklerotických lézí koronárních tepen jsou chronické uzávěry jednou z technicky nejobtížnějších pro revaskularizaci. Chronický totální uzávěr koronárních tepen (COCA) je angiografickým vyšetřením zjištěn přibližně u 20–30 % pacientů. Přítomnost CTO je nejčastějším kritériem pro volbu aortokoronárního bypassu, protože u pacientů s multicévním ischemickým onemocněním koronárních tepen je vzhledem k nízké míře úspěšné rekanalizace výkon redukován na nekompletní anatomickou revaskularizaci. Přes významný pokrok v intervenčních technologiích v posledních letech se úspěšnost perkutánní rekanalizace CTO pohybuje od 47 do 80 % (průměr 67 %). Nejčastější příčinou selhání rekanalizace CTO je neprovedení intraluminálního průchodu vodícího drátu do distálního kanálu. Dalším problémem je suboptimální antegrádní vizualizace distálního lůžka. Histologické studie odhalily, že koncentrace vláknité tkáně bohaté na kolagen je zvláště vysoká v proximální části okluze a nižší v distální části. Navíc distální pahýl častěji než proximální má zúžený tvar, příznivější pro průnik vedení. S přihlédnutím k výše uvedenému se v letech 2003-2004 díky úsilí především japonských operátorů začaly aktivně rozvíjet různé metody retrográdní (bilaterální) rekanalizace HOCA. Technologie byla vylepšena a objevily se různé strategie založené na bilaterálním přístupu, jako jsou: líbací vodicí drát, vodicí drát, přímé a reverzní techniky CART, „retrográdní vedení do skutečného lumen proximálního pahýlu“.
Účel Tato studie byla analýzou angiografických a klinických výsledků rekanalizace CTO bilaterálním způsobem.
Materiály a metody
Ve Výzkumném kardiologickém ústavu Saratov byly bilaterální intervence pro CTO provedeny u 27 pacientů. 21 mužů, 6 žen, průměrný věk 56±5 let.
Indikace k retrográdní intervenci u všech pacientů byly stanoveny na základě angiografických charakteristik chronické okluze nepříznivé pro antegrádní rekanalizaci, jako jsou: rozšířená okluze (více než 20 mm) se špatnou antegrádní vizualizací distálního lůžka, přítomnost suboptimálních stavů v oblasti oblast proximální části uzávěru (tortuozita cévy, vyvinutá laterální větev, nepřítomnost příznivého pahýlu ucpané cévy, přítomnost můstkových kolaterál), jakož i neschopnost vytvořit dostatečnou oporu pro průnik proximálně lokalizovaná okluze. Předpokladem byla přítomnost dobře vyvinutého systému kolaterál z kontraipsilaterální tepny, z nichž jedna nebo více souvisle vedly k distálnímu řečišti uzavřené tepny a měly dostatečný průměr. Několik pacientů již dříve podstoupilo stentování stenotické dárcovské tepny, aby se minimalizovala pravděpodobnost její trombózy a ischemických komplikací. Balónková dilatace kolaterál nebyla použita. Při plánování intervence bylo rozhodnuto provést prvotní pokus o antegrádní rekanalizaci u 18 pacientů. Z toho 10 pacientů po selhání antegrádního pokusu následně podstoupilo simultánní pokus o retrográdní rekanalizaci (obrázek 1). U 8 pacientů byl druhý pokus opožděn o 20-30 dní z důvodu vysoké nebo marginální spotřeby kontrastní látky a/nebo vysoké či marginální radiační zátěže. 12 pacientů dostalo indikace k primární retrográdní intervenci.
Obrázek 1. Pacient S., 47 let. V roce 2010 byla antegrádní metodou provedena rekanalizace a stenting chronického uzávěru proximálního segmentu pravé koronární tepny. V roce 2011 kontrolní koronární angiogram prokázal reokluzi stentu (A). Byl proveden pokus o antegrádní rekanalizaci, která byla komplikována tubulární disekcí cílového koronárního segmentu bez extravazace (B). Při retrográdním kontrastu je jasně zobrazeno distální řečiště pravé věnčité tepny (C) a rozvinutá síť interkoronárních anastomóz (septální kolaterály) z přední mezikomorové tepny (D). Vodicí drát a mikrokatétr byly zavedeny ze systému přední interventrikulární tepny přes septální kolaterálu (E) do distálního řečiště pravé koronární tepny. Uzavřený segment byl úspěšně rekanalizován retrográdním vodicím drátem a byla vytvořena koronární smyčka s vodicím drátem odstraněným přes antegrádní vodicí katetr (F). Dále byl zaveden balónkový katétr podél antegrádního zaváděcího katétru, bylo provedeno balónkování (G) a stentování cílového koronárního segmentu dvěma stenty o celkové délce 27 mm. Dosažený antegrádní průtok krve TIMI 3 s reziduální stenózou 0 % na všech stentech bez známek disekce (H, I)
Všichni pacienti dostávali standardní antikoagulační a protidestičkovou léčbu.
Lokalizace chronického uzávěru: pravá věnčitá tepna (17 pacientů), přední spádová tepna (9), a. circumflexe (1). Ve všech případech se léze nacházela v proximálním a středním segmentu, její délka se pohybovala od 15 do 30 mm. Dárcovská tepna kolaterál byla:
1. Pokud je uzávěr lokalizován v přední sestupné tepně - pravá věnčitá tepna (8), a. circumflexe (1).
2. Pokud je uzávěr lokalizován v a. circumflexe – pravé koronární tepně (1).
3. V případě uzávěru pravé věnčité tepny byla ve všech případech použita přední spádová tepna (tab. 1). U 5 pacientů byla angiograficky zjištěna hemodynamicky významná stenóza kolaterální dárcovské tepny, která byla eliminována implantací stentu.
Tabulka 1. Lokalizace ČTÚ a cesty zajištění
Pravá koronární tepna
Přední interventrikulární tepna
Pravá koronární tepna
Pro retrográdní přístup byly nejčastěji používány septální kolaterály (24). Rovněž byly použity apikální (2) a posterolaterální epikardiální kolaterály (1) (tab. 2).
Tabulka 2. Výběr zajištění při provádění rekanalizace CTO bilaterálně
Počet procedur (N=27)
Byly hodnoceny angiografické a okamžité klinické výsledky intervence. Angiografický úspěch byl definován jako dosažení konečného antegrádního průtoku krve TIMI 3 podél distálního řečiště tepny s reziduální stenózou menší než 30 % průměru referenční tepny při absenci větších komplikací – úmrtí, AIM (včetně v důsledku akutní trombózy dárcovské tepny), mrtvice, tamponáda vyžadující perikardiocentézu nebo chirurgický zákrok. Přímý klinický úspěch byl chápán jako úplná absence příznaků anginy pectoris nebo pokles jejích příznaků o 2 a více funkčních tříd (dle klinického vyšetření, zátěžové EKG testy).
Výsledek
V 19 případech se podařilo zavést retrográdní vodič do distálního kanálu. Dále byly použity různé strategie (tabulka 3). Nejčastěji byly prováděny techniky CART vpřed a vzad (9). V 6 případech bylo možné provést techniku vedení líbání. U 4 pacientů byl při přítomnosti rozvinuté laterální větve v proximální části plátu a nemožnosti vytvoření adekvátní zarážky pro průchod antegrádního balónku zaveden retrográdní vodič do pravého lumen proximálního pahýlu. Následně byla k zavedení antegrádního balónku použita technika kotevního balónku (3), u 2 pacientů, pokud zavedení antegrádního vodícího drátu nebylo možné, byl zachycen 300 cm retrográdní vodicí drát a vyjmut přes antegrádní vodicí katetr.
Tabulka 3. Výběr rekanalizační techniky z bilaterálního přístupu
Počet procedur (N=19)
Přímá a zpětná metoda CART
Retrográdní vedení vodiče do skutečného lumen proximálního pahýlu
Výkon byl ukončen balónkovou angioplastikou uzávěru a implantací stentu uvolňujícího léčivo. Angiografický a klinický úspěch byl dosažen u všech 19 pacientů. 16 pacientů přitom zcela postrádalo klinické i objektivní známky anginy pectoris. U 3 pacientů byl zaznamenán pokles anginy pectoris o 2 funkční třídy, zůstaly objektivní známky ischemie myokardu.
U 8 pacientů bylo zavedení retrográdního drátu neúspěšné (tab. 4). Všechny již dříve prošly pokusy o antegrádní rekanalizaci. Výkon byl zastaven u 4 pacientů pro těžký spasmus kolaterálního krevního řečiště provázený ischemickými změnami na EKG a poruchami rytmu. Změny byly reverzibilní a úplně se zastavily po odstranění vodícího drátu a mikrokatétru. U 1 pacienta došlo k perforaci septální tepny se vznikem intramurálního hematomu. U 3 pacientů byl výkon zastaven z důvodu délky trvání s přihlédnutím ke spotřebovanému množství kontrastní látky, kdy došlo ke kolaterálnímu spasmu zabraňujícímu průchod vodiče rigidního pro selektivní aplikaci nitrofarmak. Cévní spazmus tedy způsobil 7 selhání.
Tabulka 4. Důvody pro dokončení intervence, pokud byl pokus o rekanalizaci okluze pomocí bilaterální metody neúspěšný
Perforace kolaterálu septa
Vysoká nebo extrémní spotřeba kontrastní látky a/nebo vysoká nebo extrémní radiační zátěž
Diskuse
Otázkou zůstává, zda u pacientů s chronickými uzávěry, které nejsou přístupné antegrádní rekanalizaci, o endovaskulární léčbu, nebo zda je bezpečnější doporučit operaci koronárního bypassu. Na jedné straně endovaskulární technologie prošly v posledních letech výrazným vývojem a svými schopnostmi se velmi přiblížily otevřené chirurgické léčbě. V tomto ohledu se do pozornosti endovaskulárních chirurgů dostávají stále obtížněji léčitelné koronární uzávěry. Agresivnější techniky jsou však spojeny s vyšším rizikem smrtelných komplikací. Retrográdní intervence u chronických koronárních uzávěrů jsou potenciálně nebezpečné nejen pro cílovou uzavřenou tepnu ve smyslu perforace a nebezpečných disekcí, ale i pro kolaterální dárcovskou tepnu. Porucha kolaterálního průtoku krve může vést k ischemickým komplikacím. Nezapomínejte na délku zákroku, zvýšenou spotřebu kontrastní látky a radiační zátěž. Proto autoři často hovoří o nutnosti rozsáhlých endovaskulárních zkušeností k provádění takových výkonů. Pro plné posouzení účinnosti techniky navíc neexistuje dostatek studií na velkých skupinách pacientů, stávající zdroje se omezují pouze na retrospektivní přehledy na malých skupinách pacientů.
Existuje však také logické zdůvodnění pokusu o retrográdní rekanalizaci. Za prvé, ne každý chronický koronární uzávěr s jednocévní lézí podléhá koronárnímu bypassu (chirurgická léčba je zřídka nabízena pro izolovaný uzávěr pravé koronární tepny). Podle nerandomizovaných studií však rekanalizace jakékoli chronické okluze, a to i v přítomnosti velkofokálního infarktu, zlepšuje kvalitu života pacientů (pokles funkční třídy anginy pectoris, zvýšená tolerance zátěže, zvýšená ejekční frakce a zlepšení lokální kontraktilita při echokardiografii) a také dlouhodobě zlepšuje míru přežití. Navíc existuje nepotvrzená hypotéza, podle níž se rekanalizovaná koronární tepna může sama následně stát dárcem kolaterál, jak aterosklerotický proces postupuje na území jiné tepny. Doprovodná patologie bránící aortokoronárnímu bypassu, věk a odmítání kardiochirurgického výkonu pacienta rovněž umožňují zvolit minimálně invazivní léčbu.
Naše zkušenosti s prováděním retrográdních intervencí nám umožnily identifikovat několik metodologických vzorců. Pokus o antegrádní rekanalizaci byl proveden, když existovala sebemenší pravděpodobnost úspěchu. Retrográdní metoda byla zvolena, když byly vyčerpány všechny ostatní metody. Přitom u 12 pacientů byla původně zvolena technika retrográdní rekanalizace pro kombinaci řady nepříznivých angiografických stavů (proximální pahýl, suboptimální tvar pahýlu nebo jeho absence, vyvinutá laterální větev v místě okluze proximálního pahýlu) , což znemožňuje antegrádní pokus.
Při průchodu vodícího drátu byly ve většině případů použity septální kolaterály, což bylo spojeno s nižším rizikem krvácení do perikardiální dutiny a rozvojem srdeční tamponády při perforaci kolaterálu. Při poškození kolaterály septa se u jednoho pacienta vytvořil malý extravazát (intramurální hematom), který nevedl k žádným ischemickým následkům. Kromě toho byly epikardiální kolaterály často nedostatečně vyvinuté, takže nebyly vhodné pro instrumentaci. Ve srovnání s apikálními kolaterály byl septální přístup spojen s lepší vizualizací a kontrolou instrumentace. Při plánování zásahu byly preferovány pouze velké, vizualizované kolaterály CC2, což bylo způsobeno nižší pravděpodobností spasmu vedoucího k nemožnosti průchodu vodiče po kolaterále.
Volba techniky retrográdní rekanalizace závisela především na angiografických charakteristikách uzávěru. Jako nejbezpečnější byla preferována technika retrográdního průchodu vodiče do pravého lumen proximálního cévního řečiště s dalším průchodem do antegrádního vodícího katétru a vytvořením kličky. Pokud nebylo možné navést vodič správným směrem, byly použity přímé a reverzní techniky CART. Také v takových případech, zejména při výrazné tortuozitě cévy, byla použita technika líbajícího vodiče.
Z hlediska komplikací byl nejčastější překážkou výkonu kolaterální spasmus, rigidní vůči selektivnímu podání nitrofarmak.
závěry
1. Bilaterální metoda rekanalizace CTO umožňuje dosáhnout vyšší angiografické a klinické efektivity endovaskulárních intervencí rozšířením indikací pro ně.
2. Bilaterální rekanalizace chronických koronárních uzávěrů jsou technicky složité intervence spojené se zvýšeným rizikem komplikací. Použití této techniky je však zcela oprávněné, když je antegrádní přístup nemožný, existuje vysoké anestetické riziko bypassu koronárních tepen a také když pacient kategoricky odmítá kardiochirurgický výkon.
3. Pro minimalizaci počtu a závažnosti komplikací je nutný pečlivý výběr pacienta, správná volba strategie a dostatečné chirurgické zkušenosti.
4. Pro rozvoj metody je nutné dále rozšiřovat metodickou základnu a provádět randomizované studie pro hodnocení efektivity retrográdních intervencí na koronárních tepnách.
Recenzenti:
Agapov Valery Vladimirovich, doktor lékařských věd, hlavní lékař regionálního kardiochirurgického centra Ministerstva zdravotnictví Saratovské oblasti, Saratov.
Prelatov Vadim Alekseevich, doktor lékařských věd, profesor, profesor katedry chirurgie Fakulty pokročilého výcviku a pedagogických pracovníků, Státní lékařská univerzita v Saratově pojmenovaná po. V.I. Razumovsky" Ministerstvo zdravotnictví Ruska, Saratov.
Cévní uzávěr: léčba, příznaky, diagnostika
Zveřejnil: admin v Nemoci a léčba 17.05.2018 0 188 Zobrazení
Termín okluze (přeložený z latiny jako „skrývání“) se v medicíně používá k označení širokého procesu blokování průchodnosti tepen. Ucpání cév a tepen narušuje správné fungování lidských orgánů. Tato patologie vede k závažným onemocněním kardiovaskulárního systému, což vede k počtu postižených lidí a úmrtnosti.
Trombóza postihuje především tepny dolních končetin, cévy mozku a sítnici očí. Cévní léze horních končetin jsou méně časté.
Výskyt okluze je spojen se spasmem nebo vnějším škodlivým vlivem, vyvolávajícím tvorbu krevní sraženiny, která blokuje lumen.
V důsledku toho se rychlost pohybu krve snižuje, srážlivost je narušena a ve stěnách tepen vznikají patologie. Tyto procesy vedou ke kyslíkovému hladovění tkání a acidóze.
Příčiny zhoršeného průtoku krve v cévách jsou:
- Arytmie. Při narušení rytmu se v některých oblastech srdce objevují malé krevní sraženiny, které se při zvýšení tlaku uvolňují do krevního řečiště a ucpávají cévy.
- Vzduch vstupující do krevního řečiště v důsledku zranění nebo nesprávné technologie vstřikování.
- Nesprávný metabolismus. Malé tukové částice se hromadí na jednom místě a vedou ke vzniku tukové sraženiny.
- Infekce. Zánětlivé procesy vyvolávají hromadění hnisu nebo mikrobů v lumen krevních cév.
Časté onemocnění vaskulární ateroskleróza může také způsobit okluzi různého stupně. Zužuje lumen žil a tepen a je také schopen přejít z mírné formy do závažnější, to znamená k rozvoji.
V závislosti na umístění stenózy lze okluzi rozdělit do několika typů:
Nejběžnější typ patologie. Více než 50 % zjištěných případů vaskulární obstrukce se vyskytuje v popliteálních a femorálních tepnách.
Je nutné přijmout okamžitá opatření pro terapeutickou léčbu, pokud je detekován alespoň jeden z 5 příznaků:
- Rozsáhlá a přetrvávající bolest v dolní končetině. Při pohybu nohy se bolestivé pocity mnohonásobně zesilují.
- V oblasti, kde tepny procházejí, není cítit žádný puls. To je známka tvorby okluze.
- Postižené místo se vyznačuje neprokrvenou a chladnou kůží.
- Pocit necitlivosti v nohou, husí kůže a mírné brnění jsou příznaky počínajícího poškození cév. Po nějaké době se může objevit necitlivost končetiny.
- Paréza, neschopnost unést nebo zvednout nohu.
Pokud se objeví některý z výše uvedených příznaků, měli byste se okamžitě poradit s odborníkem. Při pokročilých okluzních procesech může začít nekróza tkáně a následně amputace končetiny.
Tento typ patologie zaujímá třikrát větší místo v distribuci. Nedostatek kyslíku v buňkách mozku a centrálního nervového systému je způsoben ucpáním krční tepny zevnitř.
Tyto faktory způsobují:
- Závrať;
- Ztráty paměti;
- Fuzzy vědomí;
- Necitlivost končetin a paralýza obličejových svalů;
- Rozvoj demence;
- Mrtvice.
Zúžení těchto velkých cév vede k poškození okcipitálního sektoru mozku. V důsledku toho pacient pociťuje poruchy řeči, ztrátu vědomí, dočasnou ztrátu paměti a periodické ochrnutí nohou.
Tento typ cévního poškození je nejvzácnější. Je nebezpečný, protože je asymptomatický a způsobuje náhlou ztrátu zraku. Obvykle se vyskytuje ve věku 45-50 let.
Jakýkoli typ uzávěru levé nebo pravé tepny je nebezpečný a může mít pro člověka nevratné následky.
Řada příznaků naznačuje, že se nemoc projevila. Příznaky uzávěru závisí na místě ucpání cévy.
Srdeční cévy. Okluze koronárních cév přivádějících krev do srdečního svalu je nejnebezpečnějším projevem patologie, vyplývající z ischemie nebo aterosklerózy.
Chronický průběh onemocnění může způsobit infarkt myokardu a smrt člověka. Známky ucpání srdečních cév jsou přetrvávající bolest na hrudi (i v klidu po užití léků).
Periferní cévy. Známky ucpání krevních cév na dolních končetinách jsou rozděleny do několika fází, které se od sebe liší.
- Fáze 1. Kůže je bledá, končetiny studené. Při dlouhé chůzi je cítit silná únava v lýtkových svalech.
- Fáze 2. Při chůzi se objevuje rostoucí bolest, která vám brání v pohybu na delší vzdálenosti. Objevuje se kulhání.
- Fáze 3. Trvalá ostrá bolest i v klidu.
- Fáze 4. Na kůži se tvoří vředy a gangrenózní změny.
K podezření na okluzi stačí mít alespoň jeden z uvedených příznaků.
Cévy mozku. Nedostatečná výživa mozkových buněk je plná mozkových příhod, paralýz, demence a náhlé smrti. Zablokování krčních tepen je doprovázeno ztrátou koordinace, nevolností nebo zvracením, nezřetelnou řečí a zhoršeným viděním. Ischemické ataky jsou jasnou předzvěstí mrtvice.
Obstrukce, která se vyskytuje v krční páteři, je indikována:
- Postupně se zvyšující bolest v místě růstu trombu;
- V zablokované cévě není žádný puls;
- Nedostatek výživy vede k bledé a šupinaté pokožce, vráskám;
- Následně se může vyvinout pocit necitlivosti, husí kůže a paralýza.
V závislosti na straně vývoje okluze (levá nebo pravá) může být narušeno vidění jednoho nebo druhého oka.
Okluze jakékoli formy a stadia vyžaduje důkladné vyšetření. Jsou diagnostikovány známky vznikajícího onemocnění a jsou předepsány specifické testy. Diagnostika se provádí v nemocničním prostředí.
- Cévní chirurg vyšetřuje oblast podezření na cévní blokádu. Vizuálně lze identifikovat otok, suchost, olupování a ztenčení kůže.
- Důkladné skenování tepen odhalí konkrétní umístění krevních sraženin.
- Vyšetřuje se průtok krve ve všech cévách.
- Při nedostatečné anamnéze se používají rentgenové metody a zavedení kontrastní látky.
Kromě hardwarové diagnostiky je povinné studovat krevní testy pacienta, včetně testů na cholesterol.
Diagnostika nám umožňuje identifikovat místo a stupeň obstrukce a předvídat komplikace.
Okluzi končetiny je možné léčit až po stanovení přesné diagnózy a stadia onemocnění.
Fáze 1 – konzervativní léčba s použitím léků: fibrinolytika, spazmolytika a trombolytická léčiva.
Předepisují se také fyzikální procedury (magnetoterapie, baroterapie), které s sebou nesou pozitivní dynamiku.
Fáze 2 je založena na chirurgickém zákroku. Pacient podstoupí tromboembolii a operaci bypassu k obnovení správného průtoku krve v žilních tepnách.
3. stadium - okamžitá chirurgická léčba: excize trombu s bypassem, protetika části postižené cévy, někdy částečná amputace.
Fáze 4 - začátek odumírání tkáně vyžaduje okamžitou amputaci končetiny, protože šetřící operace může vyvolat smrt pacienta.
Po operacích hraje důležitou roli v pozitivním efektu následná terapie, která zabraňuje opětovné embolii.
Je důležité zahájit léčbu v prvních hodinách rozvoje okluze, jinak začne proces gangrény, který povede k další invaliditě se ztrátou končetiny.
K prevenci ucpání krevních cév se používá řada opatření:
- Správná výživa, obohacená o vitamíny a rostlinnou vlákninu s výjimkou tučných a smažených jídel;
- Ztráta váhy;
- Neustálé sledování krevního tlaku;
- Léčba arteriální hypertenze;
- Vyhýbání se stresu;
- Minimální spotřeba alkoholu a tabáku;
- Lehká fyzická aktivita.
Pokud je přítomna trombóza, nezanedbávejte doporučení lékaře. Nemělo by se vyhýbat chirurgickým zákrokům.
Včas Zahájená terapie pro rozvoj okluze jakéhokoli typu je klíčem k uzdravení. V téměř 90 % případů dřívější léčba a operace obnoví správný průtok krve v tepnách.
Při pozdním zahájení léčby hrozí amputace končetiny nebo náhlá smrt. Smrt člověka může být způsobena nástupem sepse nebo selháním ledvin.
Cévní mozková příhoda je poměrně nebezpečné onemocnění, které postihuje lidi nejen staršího, ale i středního věku a dokonce i velmi mladé lidi.
Mrtvice je nebezpečný stav, který vyžaduje okamžitou pomoc. Často to končí invaliditou, v mnoha případech i smrtí. Kromě ucpání cévy u ischemického typu může být příčinou záchvatu i krvácení do mozku na pozadí vysokého krevního tlaku, jinými slovy hemoragická mrtvice.
Pravděpodobnost mrtvice zvyšuje řada faktorů. Ne vždy za to mohou například geny nebo věk, i když po 60 letech se ohrožení výrazně zvyšuje. Každý však může něco udělat, aby tomu zabránil.
Vysoký krevní tlak je hlavním rizikovým faktorem mrtvice. Zákeřná hypertenze nevykazuje v počáteční fázi příznaky. Proto si toho pacienti všimnou pozdě. Je důležité si pravidelně měřit krevní tlak a při jeho zvýšených hladinách užívat léky.
Nikotin stahuje cévy a zvyšuje krevní tlak. Riziko mrtvice u kuřáka je dvakrát vyšší než u nekuřáka. Je tu však dobrá zpráva: ti, kdo přestanou kouřit, toto nebezpečí výrazně snižují.
3. Máte-li nadváhu: zhubnout
Obezita je důležitým faktorem při vzniku mozkového infarktu. Obézní lidé by měli přemýšlet o programu na hubnutí: jíst méně a lépe, přidat fyzickou aktivitu. Starší dospělí by se měli poradit se svým lékařem, jak velký úbytek hmotnosti by jim prospěl.
4. Udržujte hladinu cholesterolu v normě
Zvýšené hladiny „špatného“ LDL cholesterolu vedou k ukládání plaků a embolií v cévách. Jaké by měly být hodnoty? Každý by si to měl zjistit individuálně se svým lékařem. Protože limity závisí například na přítomnosti doprovodných onemocnění. Za pozitivní jsou navíc považovány vysoké hodnoty „dobrého“ HDL cholesterolu. Zdravý životní styl, zejména vyvážená strava a dostatek pohybu, může mít pozitivní vliv na hladinu vašeho cholesterolu.
Dieta, která je obecně známá jako „středomořská“, je prospěšná pro krevní cévy. Tedy: hodně ovoce a zeleniny, ořechy, olivový olej místo oleje na smažení, méně uzenin a masa a hodně ryb. Dobrá zpráva pro labužníky: na jeden den si můžete dovolit vybočit z pravidel. Je důležité jíst zdravě obecně.
6. Mírná konzumace alkoholu
Nadměrná konzumace alkoholu zvyšuje smrt mozkových buněk postižených mrtvicí, což není přijatelné. Není nutné úplně abstinovat. Sklenka červeného vína denně je dokonce prospěšná.
Pohyb je někdy to nejlepší, co můžete pro své zdraví udělat, abyste zhubli, normalizovali krevní tlak a udrželi elasticitu cév. Ideální jsou k tomu vytrvalostní cvičení jako plavání nebo rychlá chůze. Délka a intenzita závisí na osobní zdatnosti. Důležité upozornění: Netrénovaní jedinci nad 35 let by měli být před zahájením cvičení nejprve vyšetřeni lékařem.
8. Poslouchejte rytmus svého srdce
K pravděpodobnosti mrtvice přispívá řada srdečních onemocnění. Patří mezi ně fibrilace síní, vrozené vady a další poruchy rytmu. Za žádných okolností by se neměly ignorovat možné rané příznaky srdečních problémů.
9. Kontrolujte hladinu cukru v krvi
U lidí s cukrovkou je dvakrát vyšší pravděpodobnost, že utrpí mozkový infarkt, než u zbytku populace. Důvodem je, že zvýšená hladina glukózy může poškodit krevní cévy a podporovat usazování plaku. Lidé s cukrovkou mají navíc často další rizikové faktory pro mozkovou mrtvici, jako je hypertenze nebo příliš vysoké hladiny lipidů v krvi. Proto by diabetici měli dbát na regulaci hladiny cukru.
Stres někdy nemá chybu a může vás dokonce motivovat. Dlouhodobý stres však může zvýšit krevní tlak a náchylnost k nemocem. To může nepřímo způsobit rozvoj mrtvice. Na chronický stres neexistuje žádný všelék. Zamyslete se nad tím, co je pro vaši psychiku nejlepší: sport, zajímavý koníček nebo třeba relaxační cvičení.
Okluze pravé koronární tepny
Symptomy a léčba mezenterické trombózy

Bojujete s HYPERTENZÍ již mnoho let bez úspěchu?
Vedoucí ústavu: „Budete překvapeni, jak snadné je vyléčit hypertenzi každodenním užíváním.
Nebezpečným onemocněním je střevní infarkt. Pokud lékaři nezasáhnou včas, může začít nekróza střevních stěn a zachránit člověka nebude snadné – úmrtnost dosahuje 70 %. O jaké onemocnění se jedná, jaké má příznaky?
Naši čtenáři úspěšně používají ReCardio k léčbě hypertenze. Když jsme viděli, jak populární je tento produkt, rozhodli jsme se na něj upozornit.
Více čtěte zde...
V lidském těle je zvláštní záhyb pobřišnice - mezenterium. Drží střeva pohromadě. Jeho cévy se nazývají mezenterické. Každý z nich zásobuje určitou oblast střeva. Jako každé krevní cévy se mohou ucpat krevními sraženinami.
Pokud je v nich narušen krevní oběh, člověk vyvine nebezpečné onemocnění - trombózu mezenterických cév, které se také říká střevní infarkt. Ohrožuje život člověka, protože lékaři nemohou okamžitě stanovit správnou diagnózu, zejména na začátku onemocnění, a poskytnout potřebnou pomoc.
Onemocnění je diagnostikováno u mužů i žen. Nejčastěji jsou postiženi lidé středního nebo staršího věku.
Stejně jako v jakékoli části těla probíhá střevní trombóza stejným způsobem:
Nejhorší scénář je, že plavidlo je úplně zablokované. Pak část střeva přestane dostávat látky a kyslík, které potřebuje. Střevní stěna, aniž by dostávala výživu, podléhá destrukci. Začíná střevní infarkt.
Nejprve se na sliznici objeví vředy a nekrózy. Poté se tkáně rozpadnou a ve střevě se vytvoří díra. Z něj se může celý obsah střeva dostat do dutiny břišní. Vzniká zánět pobřišnice, který často způsobí smrt pacienta.
Lokalizace a stadia onemocnění
Střevní infarkt vzniká při ucpání kterékoli části cév tohoto orgánu, nejčastěji však dochází k uzávěru kmene nebo ústí horní mezenterické tepny. Lékaři rozdělují tento kmen na 3 části. Při postižení každého z nich je postižena konkrétní část střeva.
Fáze vývoje onemocnění jsou následující:
Střevní infarkt může být důsledkem aterosklerózy mezenterických cév. Onemocnění vede k tvorbě plaku, který narušuje průtok krve. Nejčastěji se však jedná o nepříjemný důsledek různých srdečních onemocnění, při kterých se tvoří krevní sraženina. Může to být kardioskleróza, srdeční aneuryzma, infarkt myokardu atd.
Takže u člověka, který přežil infarkt myokardu, dojde k prasknutí srdečního svalu. Je doprovázeno krvácením. V místě poranění se vytvoří krevní sraženina. Když se krevní sraženiny ulomí, mohou „cestovat“ tepnami a žilami. Pokud se tato sraženina dostane do mezenterických cév, dojde k jejich ucpání a je diagnostikována trombóza mezenterických cév.
K vnitřnímu krvácení dochází i u jiných onemocnění a každé z nich může způsobit trombózu. Někdy jsou cévy stlačeny nádorem nebo se onemocnění rozvine v důsledku zranění.
Příznaky nemoci se okamžitě projeví, nemoc začíná akutně.
Tato trombóza má však i prodromální období, které může trvat 1-2 měsíce. Tyto příznaky jsou pozorovány u pacientů s vazokonstrikcí:
- občasná bolest břicha;
- žaludek je nafouklý;
- pacient pociťuje nevolnost a někdy zvrací;
- žaludek bolí pokaždé po jídle;
- židle je nestabilní.
- Ischemické stadium (trvá 6-12 hodin). Trombóza střevních cév v případě akutního nástupu se projevuje silnou bolestí. Pacient začne křičet, spěchat a nemůže najít místo pro sebe. Zmírnit tuto bolest není možné ani pomocí narkotik, ale určitou úlevu poskytují spazmolytika. Následující příznaky pomohou rozpoznat střevní trombózu:
- kůže pacienta je bledá, s namodralým odstínem;
- puls je vzácný;
- krevní tlak stoupá;
- žaludek je měkký;
- jazyk je mokrý;
- nevolnost, zvracení;
- Mnoho lidí má průjem s krví, ale může se objevit i zácpa (u čtvrtiny pacientů).
- Fáze infarktu (trvá až 24 hodin). Když projde první fáze onemocnění, po 6-12 hodinách začíná druhá, která trvá až 1 den. Jaké příznaky jsou pozorovány v této době?
- Bolest postupně ustupuje, protože již začala nekróza střevních stěn a odumřely receptory bolesti.
- Puls se zrychlí.
- V důsledku intoxikace se chování pacienta stává neadekvátním.
- Stádium peritonitidy (vyskytuje se 18-36 hodin po začátku onemocnění). Zánětlivé procesy začínají v dutině břišní, takže bolest zesílí, pokud se člověk pohybuje z místa na místo, kašle nebo palpuje. Stav pacienta se prudce zhoršuje. Lékař si všimne následujících příznaků:
- suchý jazyk;
- puls je častý, vláknitý;
- při palpaci je bolestivá celá břišní dutina;
- kůže se stává šedou;
- poklesy tlaku;
- leukocytóza je zvýšená.
Střevní trombóza bez lékařské pomoci vede ke smrti pacienta. Pokud to byla arteriální trombóza, člověk zemře po 2 dnech, pokud to bylo žilní - po 5-6 dnech.
Diagnostika a léčba
Nebezpečí tohoto onemocnění spočívá v tom, že příznaky v raných stádiích jsou podobné jako u jiných onemocnění břicha, kterých je mnoho. Nejčastěji se zaměňuje s apendicitidou. Jak se dělá přesná diagnóza?
Lékař může předepsat další, doplňková vyšetření.
Střevní trombóza je život ohrožující onemocnění. Proto je důležité v prvních hodinách nemoci vyhledat pomoc lékaře. Pokud se pacient dokázal dostat do nemocnice včas a byl okamžitě správně diagnostikován, je možná konzervativní léčba bez chirurgického zákroku.
Lékař předepíše nitrožilní léky, které rozpustí krevní sraženinu a obnoví narušené krvácení. Taková léčba je však spíše výjimkou než pravidlem, protože není možné rychle stanovit diagnózu: pacient je vyšetřen, s výjimkou jiných onemocnění (pankreatitida, cholecystitida, apendicitida atd.).
Proto často zbývá jediná možnost – operace. Pokud ještě nedošlo k nekróze, chirurg odstraní trombus, část cévy, a provede náhradu tepny. Pokud jste nestihli zasáhnout včas, musíte postiženou část střeva odstranit. Ne vždy se však podaří pacienta zachránit. Úmrtnost je velmi vysoká, s nekrózou střevní stěny – až 70 %.
Mezenteriální trombóza je nebezpečné onemocnění, které lze vyléčit pouze tehdy, pokud se včas poradíte s lékařem. Pokud tedy zaznamenáte jakoukoli bolest v oblasti břicha, je důležité okamžitě zavolat sanitku, jinak dojde ke ztrátě času. Každá minuta zvyšuje pravděpodobnost úmrtí pacienta, protože po několika hodinách může být lékařská pomoc zbytečná.
Příznaky a léčba uzávěru koronárních tepen
Okluze je náhlá cévní obstrukce. Příčinou je rozvoj patologických procesů, zablokování krevní sraženinou a traumatické faktory. Existují různé typy okluze na základě umístění; například může ovlivnit srdeční tepny. Je zásobován krví dvěma hlavními cévami – levou a pravou koronární tepnou.
Kvůli jejich ucpání srdce nedostává potřebné množství kyslíku a živin, což vede k vážným problémům. Na přijetí mimořádných opatření jsou často jen minuty, někdy hodiny, proto je nutné znát příčiny a příznaky okluze.
Procesy, které se vyskytují při tvorbě uzávěru koronárního typu, do značné míry určují morfologii. Nejčastěji se chronická okluze začíná tvořit od okamžiku vytvoření čerstvého intraluminálního trombu. Právě ta vyplňuje lumen po prasknutí vazivového pouzdra nestabilního aterosklerotického plátu u akutního koronárního syndromu.

K tvorbě trombů dochází ve dvou směrech od plaku. Délka okluze je určena umístěním velkých laterálních větví vzhledem k okluznímu plátu.
Existuje několik fází tvorby struktur chronického uzávěru srdečních tepen.

Tvorba aterosklerotických plátů na koronární tepně
Proč se takové procesy začínají rozvíjet? Výše uvedené se samozřejmě u zdravého člověka s dobrými cévami neděje. Aby došlo k náhlé neprůchodnosti cév nebo k chronickému uzavření uzávěru, musí na srdce a koronární tepny působit některé faktory. Normální průtok krve je skutečně omezen z několika důvodů.
Pokud začnete žít tímto nesprávným způsobem od mládí, mohou nastat vážné problémy. Bohužel jsou pozorovány i u těch, kteří kdysi vedli nezdravý životní styl, samozřejmě stupeň onemocnění není tak akutní. Pokud odstraníte negativní faktory ze svého života co nejdříve, pravděpodobnost vzniku okluze bude mnohem menší.
Projev příznaků je přímo závislý na práci srdce, protože právě srdce je poškozováno. Protože v důsledku okluze přestává přijímat výživu a kyslík, nemůže to zůstat bez povšimnutí člověka. Práce srdce trpí a to se projevuje bolestí v této oblasti. Bolest může být velmi silná. Osoba začíná pociťovat potíže s dýcháním. V důsledku kyslíkového hladovění srdce se mohou v očích objevit plováky.
Člověk prudce zeslábne. Pravou nebo levou rukou může uchopit oblast srdce. V důsledku toho tato situace často vede ke ztrátě vědomí. Je třeba vzít v úvahu, že bolest může vyzařovat do paže nebo ramene. Známky jsou velmi výrazné. V každém případě je nutné poskytnout první pomoc.
Je nutné zmírnit bolest a křeče. K tomu byste měli dát anestetikum. Je dobré, pokud je možné aplikovat papaverin. Pokud má člověk u sebe léky na srdce, musí být podány ve správné dávce.
Po poskytnutí pomoci lékařským specialistům je oběť převezena do nemocnice. Tam je pacient vyšetřen. EKG je k dispozici v každém zdravotnickém zařízení. Při jeho dešifrování se bere v úvahu hloubka a výška zubů, odchylka izočáry a další znaky.
Provádí se také ultrazvuk srdce a cév a tepen. Tato studie pomáhá identifikovat důsledky okluze a poruch krevního toku. Užitečné je provedení koronarografie srdečních cév se zavedením kontrastní látky.
Léčba akutních projevů uzávěrů je komplexní záležitost. Jeho úspěšnost závisí na včasném odhalení prvních příznaků poškození koronárních tepen. V zásadě je nutné uchýlit se k chirurgické intervenci, aby se vyčistily vnitřní dutiny tepen a odstranily postižené oblasti. Provádí se arteriální bypass.
Abychom k tomu tělo nepřivedli, je nutné udržovat kardiovaskulární systém v normálním stavu. K tomu je třeba přijmout řadu preventivních opatření:
Díky takovým jednoduchým opatřením se můžete chránit před nebezpečnými následky. Je důležité pochopit, že okluze představuje skutečnou hrozbu pro lidské zdraví a život. Musíme tomu zabránit nebo poskytnout první pomoc!
Komplikace koronární angioplastiky zcela ucpané tepny
Kromě toho je přítomnost kompletní chronické okluze před intervencí nezávislým prediktorem akutní okluze po intervenci. Frekvence akutního koronárního uzávěru při pokusu o rekanalizaci chronického uzávěru je 5-10 %, akutní IM - 0-2 %, akutní CABG - 0-3 %, úmrtí - 0-1 % (tab. 1.29, 1.30). Podle některých studií bylo 8 % úspěšně dilatovaných totálních uzávěrů (bez implantace koronárních stentů) reokluzí do 24 hodin oproti 1,8 % akutních uzávěrů po PTCA subtotálních stenóz. V 87 % případů však byly reokluze asymptomatické (viz tabulky 1.29, 1.30). V jiné studii byla míra komplikací pro rekanalizaci kompletních chronických okluzí 20 % u pacientů s nestabilní anginou pectoris a 2,5 % u pacientů se stabilní anginou pectoris. Akutní ischemické komplikace totální chronické okluzní koronární angioplastiky jsou spojeny s disekcí nebo trombózou dříve dilatovaného segmentu, s okluzí boční větve nebo s distální embolizací. Mezi vzácné komplikace patří perforace okludované tepny, ruptura nebo destrukce koronárního vodiče nebo nefropatie z předávkování kontrastní látkou. Akutní okluze po úspěšné rekanalizaci okluze mohou způsobit akutní klinickou nestabilitu v důsledku obnovení kolaterálního krevního toku, který po úspěšné rekanalizaci ustává a po akutní okluzi se obnovuje mnohem pomaleji.
Angioplastika kompletních chronických uzávěrů: symptomatický stav při dlouhodobém sledování
Úroveň restenózy a reokluze po rekanalizaci koronárních okluzí
Dlouhodobé výsledky rekanalizace kompletní chronické okluze
Naprostá většina pacientů po úspěšné angioplastice zcela uzavřené koronární tepny nemá dlouhodobě žádné příznaky onemocnění (viz tab. 1.29). Ve 3 velkých studiích bylo 76 %, 69 % a 66 % pacientů asymptomatických 1 rok, 2 roky a 4 roky po koronární angioplastice. Absence příznaků anginy pectoris nevylučuje přítomnost restenózy, která je ve 40 % případů přítomna při absenci anginy pectoris po rekanalizaci zcela okludované tepny (tab. 1.31, 1.32).
PTCA nekompletních a kompletních chronických koronárních uzávěrů: dlouhodobé výsledky
Úspěšná angioplastika chronické totální okluze: dlouhodobé výsledky
Přestože údaje o funkci LK po účinné rekanalizaci jsou omezené, úspěšná koronární angioplastika zlepšuje jak globální, tak regionální funkci LK. V jedné studii měli pacienti, kteří měli úspěšnou rekanalizaci s následnou průchodností dříve nemocné tepny a normálním koronárním průtokem, lepší celkovou LVEF a menší dilataci dutiny LK ve srovnání s pacienty, kteří rekanalizaci nepodstoupili.
Většina studií zjistila, že úspěšná rekanalizace chronické totální okluze snižuje potřebu CABG v 50–75 % případů. Koronární angioplastika však ve srovnání s CABG nemá výhody ani nevýhody z hlediska přežití a rozvoje pozdějšího infarktu myokardu u této skupiny pacientů.
Výběr potřebného nástroje pro koronární angioplastiku u pacientů s kompletní chronickou okluzí
Koronární angioplastika kompletní chronické okluze je jednou z nejsložitějších intervencí v intervenční kardiologii. PTCA s úplným uzávěrem je oproti nekompletní (funkční) okluzi nákladnější intervencí (vzhledem k velkému množství potřebných vodících katetrů, intrakoronárních vodicích drátů, balonků apod.). Je třeba poznamenat, že doba procedury se prodlužuje a je stanovena vyšší míra radiační expozice jak pro pacienta, tak pro lékaře.
Předpokladem pro výběr zaváděcího katétru je maximální repulzní odpor, který je nutný pro průchod koronárního drátu a následně katétrového balónku koronárním uzávěrem. Pro rekanalizaci chronického uzávěru v povodí levé věnčité tepny se nejčastěji používají katetry typu Waud a Amplatz pro levou věnčitou tepnu, které zajistí jejich nejstabilnější fixaci v ústí levé věnčité tepny. V povodí pravé věnčité tepny se doporučuje katétr typu AtrMg pro levou věnčitou tepnu a typ Uod pro pravou věnčitou tepnu. Pokud používáte zaváděcí katetr Junkinsova typu nebo multifunkční zaváděcí katetr, doporučujeme použít hluboký fixační systém katetru na ústí koronární arterie, aby se zlepšila stabilní fixace hrotu katetru. Velikost vnitřního lumen zaváděcího katetru také určuje tuhost fixace katetru v ústí koronární tepny. Čím větší je průměr katétru, tím pevněji bude fixován v ústí tepny. Kompromisní velikost (průměr-tuhost) je zaváděcí katétr 8 F. Při použití vodicích katétrů o velikosti 8 F nebo větší je však lékař omezen v zasouvání hrotu katétru do lumen věnčité tepny. to znamená při použití techniky „hluboce fixovaného katétru“.
Účelem této techniky je vytvořit pevnější strukturu vodícího katetru + arteriálního ústí.
Tento efekt spočívá v hlubším průniku distální části katétru do ústí věnčité tepny a její tužší fixaci v lumen (obr. 1.106, A-B). Při průchodu koronárního vodiče postiženým segmentem nemůže balónek běžící podél vodiče překročit postiženou oblast (důvody: tvrdá stenóza, klikatý segment, kompletní chronická okluze atd.) (viz obr. 1.106, A) a vedení katetr neposkytuje dostatečnou oporu, je možná trakce katetrizačního balónku (viz obr. 1.106, B) v opačném směru (směrem k vodícímu katetru) pod kontrolou kvalitního skiaskopického obrazu. Beze změny polohy vodiče se současně posune distální část zaváděcího katetru dopředu (viz obr. 1.106, B). Po této manipulaci se hrot zaváděcího katétru posune mírně dopředu a pevněji se zafixuje v ústí tepny (viz obr. 1.106, B). Poté je nutné opakovat pokus o posunutí balónku přes postiženou oblast. Tuto techniku lze použít za přítomnosti vodícího katétru o velikosti maximálně 7 F a bočních perfuzních otvorů v zakřivené části katétru se speciální atraumatickou špičkou. Kmen levé věnčité tepny by měl být poměrně velký (4 mm a více) a bez známek koronární aterosklerózy (zúžení, viditelná kalcifikace).
Schéma pro použití hluboce fixovaného katétru
Diskety, standardní a střední řady drátů jsou nejoblíbenějšími zařízeními pro chronické totální okluze, ale někteří lékaři dávají přednost použití pevných nebo gliadewire drátů.
Měkké (floppy) koronární vodiče úspěšně procházejí okluzí ve 30–50 % případů, kdy „stáří“ okluze není delší než 6 měsíců. Pevné koronární dráty zvyšují úspěšnost intervence o dalších 25 %, ale těchto dalších 25 % uzavřených tepen nebylo možné rekanalizovat pomocí jiných koronárních drátů. Pro rekanalizaci lze samozřejmě vybrat 0,014-palcové koronární dráty, ale pro zlepšení průchodnosti se častěji používají 0,016- nebo 0,018-palcové dráty. Ve velmi vzácných případech se k dosažení úplné okluze používají vodicí dráty 0,035-0,038 palce. Nedoporučujeme však používat k průchodu uzavřeným segmentem vodicí dráty > 0,021 palce, aby se zabránilo subintimálnímu poranění uzavřené tepny a perforace cévy.
Pokud je při kontrolní koronarografii možné zobrazit pookluzní plnění koronární tepny (za přítomnosti dostatečného kolaterálního průtoku krve), pak je vhodné použít freeze-frame kontrolní koronarografie (freeze-frame, podobná možnost existuje ve všech moderních digitálních angiografických systémech) za účelem určení směru postupu koronárního drátu okluzí. Další průchodnosti koronárního drátu lze dosáhnout pomocí balónkového katétru nebo speciálního transportního katétru (sondovací katétr, „katétr bez balónku“, „koronární bougie“), který se umístí 1-2 cm za vrchol koronárního drátu. Pokud je možné alespoň jednou protáhnout koronární drát okluzní zónou a potvrdit tento průchod, pak nelze polohu drátu před angioplastikou změnit (jinak se druhý pokus o úspěšný průchod drátu nemusí opakovat!). Hlavními znaky úspěšného průchodu koronárního drátu okludovaným segmentem je volná rotace hrotu drátu (viditelná na skiaskopickém snímku) a možnost nerušené trakce koronárního drátu v předozadním směru. Nejjasnějším potvrzením intraluminální polohy distální části koronárního vodiče v tepně je injekce kontrastní látky ústím bazilární tepny nebo lumen transportního katétru (sondovací katétr). Možnými známkami nesprávné instalace koronárního vodícího drátu (paravazální poloha) může být absence volné rotace distální části vodícího drátu a nerušený pohyb vodicích drátů tam a zpět, nemožnost protáhnout balonek katetru uzavřeným segmentem. Pokud jsou při zásahu zjištěny vyjmenované znaky, pak se koronární vodič nachází v subintimálním prostoru nebo v některém z malých můstkových kolaterálů. V tomto případě může balónková angioplastika mimo okludovaný segment vést k rozvoji koronárních komplikací.
Gliadewire (výrobce Mansfield/Sci-Med) je koronární drát, který se úspěšně používá při periferních angioplastikách a zavádění stentu a nyní v kardiologii. Zvláštností tohoto vodiče je, že je vyroben ze slitiny titanu a niklu (nitinol) a má hydrofilní polyuretanový povlak, který tomuto vodiči dodává vysokou pružnost a průchodnost prostřednictvím velmi klikatých a uzavřených segmentů a také vysokou odolnost proti zlomení a deformaci. Třícentimetrový hrot tohoto vodiče je velmi měkký a pružný, což usnadňuje atraumatický průchod drátu do nepřístupných segmentů koronárního řečiště. Malá série studií podporuje skutečnost, že Gliadewire lze úspěšně použít u 36–60 % okluzí, kde bylo použití standardních intrakoronárních drátů neúčinné (tab. 1.33).
Výsledky použití různých vodičů pro rekanalizaci okluzí
Velikosti gliadewire se pohybují od 0,016 do 0,025 palce. Nevýhodou tohoto drátu je nedostatečná vizualizace v koronárním řečišti a nemožnost změny tvaru v distální části drátu.
Koronární tepny přivádějí okysličenou krev do srdečního svalu. Když se to stane ucpání koronárních tepen(nejprve neúplné), hovoří o ischemické chorobě srdeční.
V tomto případě je normální zásobování krví narušeno a existuje vážné nebezpečí pro srdce a celé tělo.
Li ucpání koronárních tepen- úplné, pak nenapravitelné poškození je způsobeno odpovídající oblasti srdce. Koronární (koronární) srdeční onemocnění vede žebříček příčin předčasné smrti.
Ti, kteří trpí ucpanými koronárními tepnami, jsou vystaveni vysokému riziku srdečního infarktu nebo infarktu myokardu. Toto onemocnění nešetří ani ženy, ani muže, a to v obou skupinách úmrtnost na něj je poměrně vysoká.
Příčiny koronárního onemocnění
K blokádě koronárních tepen dochází primárně v důsledku intravaskulárních usazenin – plátů tuku, cholesterolu, vápníku nebo pojivové tkáně.
Hlavní důvody jsou následující:
- Ztluštění stěn tepen , dodává krev do srdečního svalu.
- Hromadění tukových plátů na stěnách koronárních tepen.
- Zúžení koronárních tepen.
- Vznik nebo vstup krevní sraženiny do tepny, která blokuje cestu průtoku krve.
- Zánět stěny koronární tepny.
Blokády mohou nastat v jedné nebo více tepnách, bez ohledu na jejich umístění. Závažnost onemocnění se může lišit. Protože narušuje normální zásobování srdce krví, Mohou se objevit příznaky jako bolest na hrudi a dušnost.
Příznaky koronárního onemocnění

Jedním z hlavních problémů této nemoci je, že se rozvíjí pomalu, někdy v průběhu let. Je tedy vysoká pravděpodobnost, že na počátku onemocnění se koronární insuficience neprojeví žádnými výraznými příznaky.
Díky tomu je nemoc často odhalena až v pozdní fázi, kdy je již obtížně léčitelná.
Příznaky koronárního onemocnění se liší od člověka k člověku a případ od případu, ale stále můžete identifikovat obecné příznaky:
- Nepohodlí nebo bolest na hrudi (angina pectoris)
- Dušnost
- Velmi unavený po cvičení
- Bolest v pažích nebo ramenou
- Nadměrné pocení
- Nevolnost
Rizikové faktory

Jak většina lidí stárne, obvykle dochází k určitému kornatění tepen. Existují však rizikové faktory, které mohou tento proces urychlit nebo způsobit zablokování tepny jiným způsobem:
- Podlaha: Riziko infarktu je vyšší u mužů než u žen.
- Stáří: U mužů se pravděpodobnost zablokování koronárních tepen zvyšuje od čtyřiceti pěti let, u žen - od padesáti pěti let.
- Genetické faktory: Trpí některý z vašich rodičů nebo prarodičů srdečním onemocněním?
- Obezita a nadváha.
- Pasivní životní styl.
- Vysoká hladina cholesterolu.
- Vysoký tlak.
- Diabetes.
- Stres.
- Nadměrná konzumace alkoholických nápojů.
- Nadměrná konzumace tučných, vysoce kalorických potravin vysoký obsah cholesterolu a cukru.
Zablokované koronární tepny: lze tomu zabránit?
Situace je zde stejná jako u jiných chronických onemocnění. Koronárnímu onemocnění, stejně jako jiným zdravotním problémům, lze v první řadě předcházet.
- Udržujte si normální váhu.
- Zvyšte příjem celozrnných výrobků, ovoce a zeleniny; to pomůže vyčistit tepny a zlepšit zdraví srdce. Měli byste se také vyhnout konzumaci nasycených tuků, červeného masa a zpracovaného masa.
- Provádějte pravidelná tělesná cvičení přizpůsobená vašemu věku a fyzickým schopnostem.
- Pokud kouříte, přemýšlejte o tom, jak
- Pokud máte vysoký krevní tlak nebo cukrovku, je důležité je mít s pomocí lékařů pod kontrolou, abyste předešli možným nebezpečným komplikacím.
- Malá denní dávka aspirinu pomáhá předcházet ucpání koronárních tepen. Než však začnete užívat aspirin, určitě se poraďte se svým lékařem.
- Jezte více potravin s „dobrým“ cholesterolem a snažte se vést zdravý životní styl, abyste snížili množství „špatného“ cholesterolu v krvi. cholesterolu a triglyceridy.
GrSMU Journal 2008 č. 2
PRAKTIK
MDT 616.127-005.4-007.272-073.97
ELEKTROKARDIOGRAFICKÁ DIAGNOSTIKA LOKALIZACE KRITICKÉ OCLUZE V KORONÁRNÍ TEPENĚ
Část 1. TEORETICKÉ ZÁKLADY A DIAGNOSTICKÁ KRITÉRIA I.A. Serafinovich, D.G. Kornelyuk
EE "Státní lékařská univerzita v Grodnu"
Na základě analýzy a syntézy domácích i zahraničních literárních zdrojů jsou nastíněny principy, teoretické a praktické základy použití EKG metody při diagnostice lokalizace kritického uzávěru koronárních tepen u pacientů s akutním koronárním syndromem a infarktem myokardu.
Klíčová slova: elektrokardiografie, koronární tepna, diagnóza, akutní koronární syndrom, infarkt myokardu.
Na základě analýzy a zobecnění domácích i zahraničních literárních zdrojů jsou uvedeny hlavní principy a teoretická i praktická východiska aplikace EKG pro topickou diagnostiku místa uzávěru koronární tepny u pacientů s akutním koronárním syndromem a infarktem myokardu.
Klíčová slova: elektrokardiografie, koronární tepna, diagnostika, akutní koronární syndrom, infarkt myokardu.
Úvod
Existuje přímá souvislost mezi lokalizací uzávěru v koronární tepně a charakteristikou klinického obrazu infarktu myokardu (IM), jeho průběhem, mírou postižení pravé komory, rozvojem řady komplikací, post- remodelace infarktu, prognóza atd. . Totéž platí pro akutní koronární syndrom (AKS), kdy se volí léčebná taktika, u níž moderní standardy zohledňují riziko nežádoucích účinků, které přímo závisí na stavu koronární tepny související s infarktem (ICA). Hovoříme jak o poškození konkrétní cévy, tak o úrovni jejího uzávěru (proximální, střední, distální).
V zdravotnických zařízeních, kde se neprovádí koronarografie a invazivní léčba AKS a IM, je podceňován význam lokální diagnostiky trombózy a/nebo kritické stenózy koronárních tepen. IM je nejčastěji považován za homogenní systém a jeho rysy nejsou spojeny s poškozením tepen (příčinou), ale s hlavními charakteristikami infarktu
Lokalizace, hloubka, perioda (důsledek).
Tato situace se však může rychle změnit díky zavedení technologie pro invazivní léčbu AKS a IM a přehodnocení a zvládnutí použití topické diagnostiky uzávěru koronárních tepen pomocí elektrokardiografie (EKG) pomůže zlepšit detekci a hodnocení závažnosti onemocnění. choroba.
Problém má další úskalí
Neznalost lékaře se schopnostmi samotné metody při diagnostice lokalizace uzávěru v koronární tepně. Chápeme-li EKG jako grafický záznam elektrického potenciálu myokardu, je neobvyklé jej „přenášet“ do koronárních tepen.
Lokální EKG diagnostika okluze má mnoho „ale“, přijme alespoň určitou jednotnost posunu ST segmentu u pacientů s AKS, když je okluze lokalizována v pravé koronární tepně (pravá věnčitá tepna, RCA) a circumflexní věnčité tepně (LCx) levá koronární tepna, poukazující na nedostatky tohoto přístupu. Dalším „ale“ je nevyhnutelnost jejího přijetí (ať už chceme nebo ne), protože léčba AKS a IM by měla směřovat především k rychlé obnově koronárního průtoku krve, a to vyžaduje účinné kontrolní metody, nikoli nejen v době provádění invazivních manipulací, ale i po celou dobu pozorování.
Článek shrnuje moderní informace o možnostech EKG metody v diagnostice lokalizace kritického uzávěru v koronární tepně, uvádí nejčastější typy IM, reflektuje možnosti zlepšení jeho diagnostiky a souvislost s pojmy „neviditelný“ elektrokardiografické zóny myokardu“ a „srdeční infarkt“.
Práce se skládá ze dvou částí, odrážejících teoretická východiska, diagnostická kritéria, hlavní typy akutního infarktu myokardu (I. část) a jejich interpretaci, možnosti klinické aplikace, příklady, souvislosti s výše uvedenými pojmy (část II).
Terminologie stěn srdce (levé komory)
Ve většině případů nečiní potíže názvy stěn srdce (především levé komory) a související otázky terminologie IM. Dlouhou dobu jsou považovány za obecně přijímané koncepty, mají však také své vlastní charakteristiky díky „jazyku“ a novým návrhům.
Existuje určitá heterogenita ve vnímání
důkazy o dolní a zadní lokalizaci ložiska nekrózy v rusko- a anglicky (neruskojazyčné) vědecké lékařské literatuře a různé pohledy na „existenci“ samotné zadní stěny levé komory (více přesněji ojedinělé publikace zpochybňující diagnózu zadního IM). Stejně tak neexistuje shoda na tzv. předních bazálních segmentech levé komory a na hodnotě svodové aVL v diagnostice bazálních laterálních nebo středních úseků přední stěny levé komory.
Podle mezinárodní terminologie použité v článku se IM s lokalizací nekrózy v úsecích přiléhajících k bránici, vyskytující se při změnách na EKG ve svodech II, III a aVF, nazývá „dolní“. IM s lokalizací nekrózy v úsecích této stěny nad bránicí, probíhající „paralelně“ (do určité míry) k levé lopatce, vyskytující se prakticky beze změn (nebo s nespecifickými změnami) na EKG ve svodech II, III, aVF , se nazývá „zadní“. V ruskojazyčné vědecké lékařské literatuře tyto termíny odpovídají termínům „zadní“ („zadní diafragmatický“) a „zadní bazální“ IM.
Koronární tepny srdce
Ve většině případů krevní zásobení srdce (obr. 1) pochází ze dvou koronárních tepen (levé a pravé), počínaje přímo z aorty nad semilunárními chlopněmi.
Levá koronární arterie (LCA) je široký, ale krátký arteriální kmen (levý kmen hlavní koronární arterie, LMCA) asi 11 mm dlouhý a jeho větve.
Obvykle se LMCA dělí na dvě, méně často tři nebo čtyři tepny, z nichž hlavní jsou přední mezikomorová větev (přední sestupná věnčitá tepna, levá přední sestupná věnčitá tepna, LAD) a cirkumflexní větev (vlevo circumflexní koronární tepna, LCx ).
LAD probíhá podél přední mezikomorové rýhy k srdečnímu apexu (někdy prochází skrz apex k dolní stěně), kde anastomuje s RCA. Z LAD odcházejí četné septální větve (septální tepna, S1, S2 atd.), které přivádějí krev do přední části mezikomorového septa, a diagonální tepny (diagonální tepna, D1, D2 atd.), které se rozvětvují v přední části. stěny levé komory.
LCx, pohybující se po zadním povrchu levé komory, dává větve do předních a zadních papilárních svalů, přední, boční, zadní a dolní stěny levé komory, sinoaurikulárního uzlu (ve 40 % případů) a velmi vzácně , atrioventrikulární uzel (v 10 % případů společně s pravou tepnou). Velký význam mají její okrajové větve (větve tupého okraje, tupé okrajové tepny 1., 2. atd.), které přivádějí krev na posterolaterální plochu levé komory.
Pravá koronární tepna (RCA) zpočátku probíhá podél vnějšího povrchu
pravá komora, pak ve formě zadní sestupné tepny (zadní sestupná tepna) sestupuje po zadní ploše srdce k jeho apexu, kde anastomózuje s LAD. Dává větve na přední, boční a dolní stěnu pravé komory (pravé okrajové větve nebo akutní marginální tepny), dolní a zadní stěnu levé komory, dolní část mezikomorového septa, sinus (v 60 % případy přes tepnu sinusového uzlu) a atrioventrikulární (v 90 % případů) uzliny.
Frekvence koronárních lézí v populaci pacientů s IM je poněkud odlišná. Podle koronarografie je to 44–56 % pro LAD, 27–39 % pro RCA a 17 % pro LCx.
Typy krevního zásobení srdce
S přihlédnutím k variabilitě větvení věnčitých tepen (hlavně RCA a LCx) se rozlišují tři typy krevního zásobení srdce - pravé, levé a střední. Někdy je definováno pět typů, přičemž se přidávají dva střední.
Při správném typu krevního zásobení dává RCA po vzniku zadní sestupné tepny další větve na zadní stěnu levé komory. LCx je obvykle krátký a není dobře vyvinut. Končí před dosažením okraje srdce nebo pokračuje do větve tupého okraje a vyživuje pouze anterolaterální stěnu levé komory. Proto celá pravá komora, dolní a zadní stěna levé komory, zadní levý papilární sval a část srdečního hrotu dostávají krev pouze z RCA.
Při levém typu krevního zásobení je LCx velmi dobře vyvinutý, tvoří zadní sestupnou tepnu a zásobuje krví téměř celou levou komoru, celé mezikomorové septum a část zadní stěny pravé komory.
Při průměrném typu krevního zásobení jsou všechny tři koronární tepny (LAD, LCx a RCA) docela dobře vyvinuté. Tento typ je v populaci nejčastější.
U pacientů s multicévními koronárními lézemi je variabilita prokrvení srdce ještě výraznější, což je dáno především rozvojem anastomóz mezi tepnami, redistribucí průtoku krve mezi nimi (včetně retrográdních toků), tvorbou sítě zajištění a řada dalších faktorů.
Koronární angiografie
Koronarografie je dlouhodobě považována za „zlatý standard“ v diagnostice ischemické choroby srdeční (ICHS), která umožňuje vizualizaci stavu srdečních tepen po podání kontrastní látky. Přes řadu nevýhod je tato metoda s přihlédnutím ke své citlivosti a možnostem praktické aplikace hlavní v diagnostice kritického uzávěru koronární tepny.
Při popisu lokalizace koronárního uzávěru se obvykle používají standardizované systémy (schémata) koronárního řečiště. Nejrozšířenější rozdělení je na 13 segmentů (obr. 2) podle doporučení American Heart Association.
V současné době existuje 29segmentový systém (obr. 3), modifikovaný během studie BARI a vyvinutý s přihlédnutím k převládajícímu typu krevního oběhu.
Aterosklerotický plát, trombóza a křeče vedou ke snížení průsvitu koronární tepny. Vzhledem k tomu, že před studií jsou pacientovi podávány vazodilatátory, koronární angiografie odhalí pouze trombózu koronární tepny a její zúžení aterosklerotickým plátem.
Stupeň stenózy koronární tepny (spolu s lokalizací) určuje povahu a rozsah poškození myokardu. Pokles lumen koronární cévy o méně než 50 % je považován za nevýznamný a je považován za parietální změny. Hlavní patogenetickou roli hraje tzv. kritická okluze. Přes protichůdné názory jsou nejčastěji používána následující diagnostická kritéria - stenóza 50-60 % (nebo více) lumen LMCA a 70 % (nebo více) pro všechny ostatní koronární tepny.
Koronarografie má kromě svých výhod řadu omezení a nevýhod. Tyto zahrnují:
Neschopnost metody odhalit spastické reakce koronárních tepen, jejichž počet je výrazně větší než počet aterosklerotických plátů a je způsoben různorodostí celkových (stres, nachlazení, nadměrná fyzická zátěž, strach atd.), organokardiální (cholecysto-, ulcero-, atd.), koronárně-koronární, myokardio-koronární a další reflexy;
Adekvátnost koronarografie má za následek stabilní onemocnění koronárních tepen a paradoxnost její nestability (neočekávaná trombóza v místech parietálních změn při přechodu aterosklerotického plátu do stavu nestability);
Simultánnost získávání informací a nemožnost rychlé operativní kontroly v čase;
Riziko komplikací;
Soubor kontraindikací (akutní selhání ledvin, akutní mrtvice, aktivní infekční proces a další);
Metodická pravidla - vyšetření je považováno za nevhodné, pokud pacient odmítá podstoupit další invazivní léčbu nebo ji není schopen v nejbližší době provést, což vyžaduje informované rozhodnutí o jejím použití s přihlédnutím k očekávanému klinickému přínosu;
Vysoké náklady na studii, potřeba speciálního vybavení a speciálně vyškoleného personálu.
Správně ioronarvaa
Tvrdé, nesnesitelné
(mezhupdachkoval) tepna
Obrázek 1 - Koronární tepny srdce
Obrázek 2 - Segmentová struktura koronárních tepen podle doporučení American Heart Association
Obrázek 3 - Segmentová struktura koronárních tepen podle studie BARI
Elektrokardiografie
Hledání metod, které spolu s koronarografií dokážou identifikovat ISCA, nám umožnilo nový pohled na EKG. Metoda je široce používána při diagnostice IM a určení typu AKS. Zkouška je tradičně založena na systému 12 obecně uznávaných svodů. V závislosti na cílech a cílech se EKG zaznamenává do dalších systémů a svodů, z nichž jsou různé varianty mapování EKG s Wilsonovými svody, pravé hrudní svody V3R-V6R, dle Neba, Lindemanna, Evanse, Slapaka a Partilly atd. nejčastěji používané.
Analogicky k topické diagnóze IM je stanovení lokalizace kritického uzávěru koronární tepny založeno na identifikaci ischemických změn v myokardu v určitých EKG svodech, tzn. na schopnosti metody registrovat změny v procesech repolarizace a depolarizace způsobené poruchou perfuze odpovídajících segmentů myokardu.
Změny na EKG při kritické okluzi koronární tepny v počátečním období se nejčastěji projevují elevací ST segmentu, změnami tvaru a polohy vlny T, méně často poruchami vedení vzruchů myokardem a/nebo změnami v komplexu QRS. Další informace ve srovnání s „jednoduchými“ diagnostickými ukazateli poskytují „komplexní“ koeficienty a indexy, což jsou součet, rozdíl, součin nebo poměr amplitud vln Q, R, S, T a stupně ST. posunutí segmentu v různých svodech.
Můžeme předpokládat dvě hlavní možnosti vývoje indikátorů pro topickou EKG diagnostiku uzávěru v koronární tepně:
♦ Analýza vztahu mezi dvěma systémy „EKG změny – morfologická lokalizace IM“ a „morfologická lokalizace IM – lokalizace uzávěru v koronární tepně“.
♦ Přímé srovnání změn parametrů EKG a lokalizace uzávěru v koronární tepně.
Pokud je první poloha do jisté míry relativní, pak druhá má své informační pole, které nám umožňuje podívat se na oblasti prokrvení koronárních tepen trochu jinak.
EKG diagnostika lokalizace IM
Lokální diagnostika IM metodou EKG spočívá v identifikaci typických specifických změn EKG v určitých svodech obecně uznávaného systému.
Tabulka 1 - Lokální diagnostika IM pomocí EKG
Lokalizace infarktu Systém 12 obecně akceptován
myokardiální vývod
mezikomorová přepážka Vl-2
přední stěna LV V3
srdeční vrchol V4
NN boční stěna V56
bazální (vysoká) I, aVL
anterolaterální úseky levé komory
dolní stěna LV III, aVF
zadní stěna LK bez patognomických známek
V posledních letech se objevila díla Bayese de Luny a jeho spolupracovníků, kde autoři navrhují:
Patologické změny na EKG ve svodové aVL by měly být interpretovány jako charakteristické pro poškození středních segmentů přední stěny levé komory, a nikoli vysokých anterolaterálních úseků,
Odmítněte diagnózu zadního IM a interpretujte změny EKG ve svodu V1 (R/S?l) jako známky IM laterální stěny levé komory.
Tyto návrhy se setkaly s velkým množstvím námitek a v Doporučení pro standardizaci a interpretaci EKG Americké kardiologické asociace byla uvedena předchozí interpretace změn EKG ve svodové aVL a předchozí dělení IM na inferiorní a zadní, navržené KV. Mexická škola, byla zachována.
Kritéria EKG pro diagnostiku lokalizace kritické okluze v koronární tepně u pacientů s AKS
Indikátory EKG a diagnostická kritéria pro AKS jsou nejvhodněji seskupeny podle hlavních tepen a jejich segmentů.
RCA (segmenty 1–4)
Okluze RCA má za následek rozsáhlé poškození dolní stěny levé komory s častým postižením myokardu pravé komory. To vyžaduje aktivní péči o pacienty vzhledem k možné špatné prognóze, včetně úmrtí.
Kritéria pro RCA jako NÁROK jsou:
Větší elevace segmentu ST ve svodu III ve srovnání se svodem II v kombinaci se současnou depresí ST větší než 1 mm ve svodech I a/nebo aVL (senzitivita 90 % a specificita 71 %);
Navíc zvýšení ST segmentu ve svodech V1 a V3R-V4R a případně izoelektrická poloha nebo deprese segmentu ve svodu V2, což ukazuje na okluzi proximální tepny a vede k související nekróze pravé komory (senzitivita 79 % a specificita 100%);
Kromě elevace ST segmentu ve III je aVF elevace ST segmentu ve svodu V1 větší než ve svodu V3 a nedochází k žádnému zvýšení elevace segmentu z V1 na V3 pro RCA jako ISCA u pacientů se známkami předního a inferiorního infarktu.
Distální okluze RCA je indikována vzestupem ST segmentu nad izočáru ve svodech III a aVF se současnou depresí segmentu ve svodech V1-V3, kdy pokles ST segmentu ve svodu V3, ve vztahu k v. vzestup segmentu ve svodu III se pohybuje od 0,5 do 1,2.
LMCA (segment 5)
Kritická okluze LMCA vedoucí k velkému anterolaterálnímu infarktu myokardu je spojena s extrémně špatnou prognózou.
Diagnostika EKG kritické okluze LMCA je v mnoha ohledech podobná diagnostice LAD, s dalšími nálezy v některých dalších svodech.
Na kritickou stenózu a/nebo trombózu 5. segmentu LCA lze mít podezření, pokud:
deprese ST segmentu ve svodech II, III, aVF a současný výskyt blokády přední větve levého raménka (citlivost do 88 %);
elevace ST segmentu současně ve svodech aVR a aVL (specifičnost 98 %);
Elevace ST segmentu ve svodu aVR ve větší míře než u svodu V1, s výskytem blokády levého raménka nebo jeho přední větve.
Časopis GrSMU 2008 č. 2
PRAKTIK
LAD (segmenty 6–10)
Trombóza nebo kritická stenóza LAD je obvykle spojena s infarktem myokardu přední stěny levé komory a má často špatnou prognózu, zvláště když je kritická okluze proximální. V topické diagnostice lézí LAD se využívá řada EKG kritérií, nejčastěji ovlivňujících změny v úseku ST ve svodech V1-V3, I a aVL.
Na kritickou stenózu a/nebo trombózu proximálního LAD lze předpokládat, pokud:
Detekce elevace ST segmentu ve svodech V1, V2, V3 s depresí ST segmentu (>1 mm) ve svodech II, III, aVF (senzitivita 34 %, specificita 98 %);
Elevace úseku ST ve svodech I, aVL, V1 s nezměněnou vlnou T ve V1;
Elevace segmentu ST ve svodu V1 je větší než ve svodu aVR;
Elevace ST segmentu současně ve svodech aVR a aVL o více než 0,5 mm s depresí ST segmentu větší než 1 mm ve svodech II, III, aVF;
deprese segmentu ST ve svodech II, III, aVF a svodu V5;
Deprese segmentu ST ve svodu III je větší než elevace segmentu ST ve svodu aVL.
Segment 6 se obvykle dělí na 2 podsegmenty – od počátku LCx po S1 a od S1 po D1.
Okluze LAD v segmentu 6 proximálně k S1 je indikována elevací ST segmentu ve svodech V1 (>2,5 mm), V2, V3 s nově vzniklým blokem pravého raménka a vznikem Q vlny předcházející vlně R ve svodu V1 (senzitivita 12 %, specificita 100 %) a elevace ST segmentu v aVR svodu (senzitivita 43 %, specificita 95 %).
Okluze LAD v segmentu 6 proximálně k D1 je indikována součtem deprese ST segmentu ve svodech III a aVF větším nebo rovným 2,5 mm.
Distální okluze LAD (segmenty 7-8, po odchodu D1) je charakterizována identifikací na EKG elevace ST segmentu ve svodech V1, V2, V3 s depresí ST segmentu (<1 мм) или его незначительным подъемом (<2 мм) в отведениях II, III, aVF (чувствительность 66%, специфичность 73%) .
Navrhli jsme další kritéria pro proximální okluzi LAD ve formě EKG syndromu pomocí odvozených indikátorů ovlivňujících změny R, S a T vln.
DJ (segment 9)
Izolovaný uzávěr 9. segmentu LAD s předním IM je detekován ve 2 % případů. Léze první diagonální větve, vzhledem k široké oblasti krevního zásobení a variabilitě a stupni vývoje, může vést k poměrně velké oblasti infarktu nebo nastat s nespecifickými změnami na EKG.
Nejcharakterističtější příznaky kritické okluze D1 jsou:
Elevace úseku ST ve svodech I a aVL při zachování polohy segmentu na izolině ve svodech V1 a V6;
Elevace ST segmentu ve svodech aVL a V2 bez posunu segmentu ve svodech V3-V6;
Elevace ST segmentu ve svodech aVL a V2 se současnou depresí segmentu ve svodech II a III nebo V4-V5.
Zvláštní pozornost je třeba věnovat jak elevaci úseku ST ve svodech I a aVL, tak izoelektrické poloze ST ve svodu V3.
LCx (segmenty 11–13)
EKG diagnostika uzávěru LCx má své obtíže spojené s jeho prokrvením zadní stěny levé komory (týká se neviditelných elektrokardiografických zón myokardu) a nutností diferenciace (částečně ze stejného důvodu) s poškozením LAD. a RCA. V závislosti na úrovni okluze a typu prokrvení srdce je možný rozvoj IM laterální, zadní, dolní a/nebo přední stěny levé komory.
Je třeba vzít v úvahu známky kritické stenózy a/nebo trombózy LCx:
Ekvivalentní elevace ST segmentu ve svodech II a III s izoelektrickou nebo ST segmentovou elevací ve svodech aVL, možná ve V5-V6, a deprese ST segmentu ve svodech V1 a V2, možná ve V3 (senzitivita 83 % a specificita 96 %)
Deprese ST segmentu (více než 1 mm) v aVR svodu (senzitivita 80 % a specificita 96 %).
Elevace ST segmentu ve svodu aVL se současnou depresí segmentu ve svodu V2 je známkou okluze první větve tupého okraje.
Analýza změn parametrů EKG v závislosti na umístění uzávěru v koronární tepně umožnila identifikovat několik typů IM (tab. 2 a 3) s převážně přední a inferiorní lokalizací.
Níže uvedené možnosti nejsou zdaleka jediné. Byly navrženy různé přístupy k systematizaci změn EKG v různých svodech, jejichž rozdíly jsou ovlivněny kritériem přijatým jako základ – posun ST segmentu nebo patologická Q vlna. ve vlnách komplexu QRS se částečně nemusí shodovat. Zóna posunutí segmentu ST, odrážející poškození myokardu, je vždy širší než patologická zóna Q, což odráží převážně nekrotické změny v myokardu. Nestačí definitivně posoudit budoucí umístění nekrózy pouze pomocí markerů poškození.
kde 1 je elevace segmentu ST vzhledem k izolinii, i je deprese segmentu ST vzhledem k izolinii. Tabulka 3 - Typy inferiorního IM s okluzí RCA a LCx
Tabulka 2 - Typy předního IM u okluze LAD
Typy IM Lokalizace okluze Segment LAD Hlavní změny EKG
Typ 1. Bazálně-apikální MI Proximální části před vznikem Di 6 Hlavně?ST v I a aVL. tST ve Vi-V6 (na počtu svodů s elevací ST nezáleží). Simultánní?ST ve III a aVF.
Podtyp - bazální přední IM Izolovaná okluze první diagonální větve (Di) 9 tST v I a aVL. Izoelektrická poloha ST segmentu ve svodu V3. ¿ST ve II, III a aVF.
Typ 2. Septální-apikální MI Střední sekce 7 tST ve V1-V5. tST (<2 мм) в отведениях III и аVF (при распространении LAD на нижнюю стенку) или его изоэлектрическое положение в этих отведениях (при окончании артерии на передней стенке) Одновременная ¿ST в I и aVL (при распространении LAD на нижнюю стенку) или его изоэлектрическое положение в этих отведениях (при окончании артерии на передней стенке).
Typ 3. Apikální MI. Střední (když LAD zasahuje do dolní stěny) nebo distální úseky (když tepna končí na přední stěně) 7-8 tST ve V1-V2, V3 nebo V4.
Typy IM Lokalizace okluze Segment Hlavní změny EKG
Typ 1. IM dolní stěny levé komory a pravé komory Proximální části RCA 1-2 ^T ve III, aVF, v menší míře ve II (Tp/Tsh<1). в отведениях aVL и I (Хк XaVL). ^Т или его изоэлектрическое положение в отведениях Vl-V3 (у больных с признаками переднего и нижнего инфаркта). ^Т в дополнительных правых отведениях V3R-V4R.
Typ 2. MI dolní stěny s depresí 8T v hrudních svodech Distální části RCA 3-4 T ve III, aVF, v menší míře ve II (Tp/Tsh<1). в отведениях aVL и I (Хк XaVL). в отведениях V1-V3 (в меньшей степени в V2) 0,5<^3/Тш?1,2. Нет реципрокного увеличения амплитуды зубца R в грудных отведениях.
Typ 3. Infero-posteriorní MI LCx 11-12 ^T především ve II, v menší míře ve III, aVF (TP/TS>1). ^T neboli izoelektrická poloha segmentu 8T ve svodech aVL a I. Výrazná deprese 8T ve svodech V1-V3 (v menší míře V1) a někdy v ^3DSh>1,2 Zvýšená amplituda vlny Rv1 ^? 7 mm) a jeho šířka (více 40 ms). R/Svl = 1,2. ^T ve svodech V7-V9.
kde \ je vzestup segmentu 8T vzhledem k izočárě, X je pokles segmentu 8T vzhledem k izočárě.
Závěr
Prezentované teoretické základy a kritéria pro topickou diagnostiku EKG kritického uzávěru v koronární tepně ovlivňují její hlavní, nejčastější lokalizace.
Analýza indikátorů EKG s minimálními změnami, která umožňuje posoudit uzavření lumen koronární tepny, naznačuje, jak
Často v naší práci bez údajů o hladině troponinů a MB frakci kreatinfosfokinázy včas diagnózu IM nestanovíme.
Možnosti praktické adaptace a kontroverzní otázky topické EKG diagnostiky kritického uzávěru v koronární tepně jsou uvedeny v části II.
Je známo, že ateroskleróza je závažný patologický proces, při kterém se cholesterolové plaky usazují na stěnách cév a brání normálnímu průtoku krve. Koronární ateroskleróza je stejné onemocnění, které se vyvíjí v koronárních tepnách, které zásobují srdce. V důsledku tohoto procesu se snižuje prokrvení tohoto orgánu, stěny tepen hrubnou a stávají se méně elastickými, což prudce zvyšuje pravděpodobnost rozvoje srdečního infarktu. Abyste nemoc identifikovali včas a správně s ní bojovali, měli byste znát příčiny a projevy této nemoci.
Příčiny ucpání krevních cév
Podle lékařů je vývoj tohoto patologického stavu přímo či nepřímo ovlivněn více než 200 důvody. Mezi nejčastější důvody patří:
- zvýšená hladina cholesterolu v krvi, cholesterol je příčinou tvorby plaků);
- hypertenze;
- kouření (tabák obsahuje látky, které negativně ovlivňují stav krevních cév);
- nadváhu.
Kromě toho nelze slevit z dědičnosti, stejně jako ze špatných stravovacích návyků, když člověk zneužívá živočišné tuky a.
Příznaky ucpaných koronárních tepen
Člověk, který má předpoklady pro aterosklerózu, musí sledovat svůj zdravotní stav a poslouchat vlastní tělo, které může dávat signály o rozvoji nemoci. Je třeba věnovat pozornost následujícím příznakům aterosklerózy:
- tlaková nebo pálivá bolest na hrudi, která vyzařuje do levého ramene nebo zad;
- dušnost, která znepokojuje nejen po dlouhé chůzi a překonávání překážek, ale také v klidu, například v noci;
- těžké závratě;
- nevolnost a zvracení.
Musíte pochopit, že ateroskleróza se projevuje příznaky určitého onemocnění, například angina pectoris nebo kardioskleróza. V tomto ohledu se vyplatí dávat pozor na bolesti na hrudi jako u anginy pectoris, které se však užíváním nitroglycerinu neuleví. Může se také objevit otok a dokonce ztráta vědomí. Jak ukazuje praxe, více než 70% lidí, kteří prodělali infarkt, zaznamenalo výše uvedené příznaky.
Diagnostika cévní blokády
Identifikace tohoto onemocnění obvykle není obtížná. Lékař může mít podezření na aterosklerózu na základě příznaků uvedených pacientem při schůzce. K potvrzení diagnózy musí pacient podstoupit řadu následujících postupů:
- srdeční elektrokardiogram;
- radionuklidové studie;
- echokardiografie;
- elektronová tomografie;
- počítačová tomografie.
Léčba cévních blokád
Léčba tohoto onemocnění podle lékařů do značné míry závisí na stadiu aterosklerózy. V počáteční fázi vývoje onemocnění postačí užívání léků snižujících hladinu cholesterolu. Kromě toho je nesmírně důležité změnit svůj životní styl, což znamená vzdát se, dodržovat dietu, vyhýbat se stresovým situacím a pravidelně se věnovat mírné fyzické aktivitě.
Když vyšetření odhalí pozdější stadium aterosklerózy, kdy léčba léky nestačí, mohou se specialisté rozhodnout zúženou cévu chirurgicky rozšířit, tedy implantovat stent. Možností, jak problém vyřešit, může být koronární bypass, což znamená vytvoření další cesty pro průtok krve obcházející postiženou oblast. Pokud dojde k výraznému zúžení hlavní tepny vedoucí k srdci, pacient podstoupí bypass koronární tepny.
Musíte jen pochopit, že účel bypassu je extrémní opatření, což znamená, že neexistuje žádné jiné řešení problému. V každém případě je nemožné léčit aterosklerózu koronárních tepen vlastními silami. Je důležité získat kompetentní radu od specialisty a dodržovat všechna lékařská doporučení. Starej se o své zdraví!
Chronické celkové uzávěry koronárních tepen: morfologie, patofyziologie, technika rekanalizace
TAK JAKO. Těreščenko, V.M. Mironov, E.V. Merkulov, A.N. Samko Federální státní rozpočtová instituce RKNPK Ministerstvo zdravotnictví Ruské federace, Moskva
Abstraktní
Perkutánní koronární intervence (PCI) pro chronické uzávěry koronárních tepen (COA) je rychle se rozvíjející oblastí intervenční kardiologie. Rekanalizace koronárních tepen je technicky náročná intervence. Nejčastějším důvodem neúspěšné rekanalizace CTO je neschopnost protáhnout intrakoronární vodicí drát proximální a distální okluzí. Pro pochopení morfologie a patofyziologie CTO byly v posledních letech provedeny studie, na jejichž základě byly vyvinuty a uvedeny do praxe specializované nástroje a techniky pro rekanalizaci CTO. Také v tomto článku jsou na základě klinických studií popsány nejúčinnější stenty pro CTO s nízkým počtem restenóz.
Klíčová slova: chronický uzávěr koronárních tepen, ischemická choroba srdeční, perkutánní koronární intervence, rekanalizace.
Chronické totální uzávěry koronárních tepen: morfologie, patofyziologie, technika rekanalizace
TAK JAKO. Těreščenko, V.M. Mironov, E.V. Merkulov, A.N. Ruský kardiologický výzkumný komplex Samko, Moskva
Perkutánní koronární intervence (PCI) u chronických totálních uzávěrů koronárních tepen (CTO) je rychle se rozvíjející obor intervenční kardiologie. Rekanalizace koronárních tepen je technicky náročná intervence. Nejčastější příčinou neúspěšné rekanalizace CTO je selhání prokřížení intrakoronárního drátu proximálním a distálním uzávěrem CTO. Aby bylo možné porozumět morfologii a patofyziologii CTO, byla v posledních několika letech vyvinuta a uvedena do praxe specializovaný nástroj a techniky pro rekanalizaci CTO. V tomto článku na základě klinických studií přehled nejúčinnějších stentů u CTO s nízkou mírou restenózy.
Klíčová slova: perkutánní koronární intervence, ischemická choroba srdeční, chronické totální uzávěry, rekanalizace.
Chronická okluze koronární arterie (COA) je nepřítomnost antegrádního průtoku krve koronární arterií (T1M1 0 krevní průtok) po dobu delší než 3 měsíce. CTO se obvykle detekuje koronarografií (CAG). V registru 6000 pacientů s významným onemocněním koronárních tepen mělo 52 % pacientů alespoň jednoho CTO. Hlavní překážkou k dosažení úspěšné rekanalizace je neschopnost protáhnout intrakoronární vodicí drát za místo okluze. Neúspěšná rekanalizace koronární tepny ovlivňuje volbu další taktiky léčby pacientů. Podle mezinárodních údajů mohou pacienti s identifikovaným CTO a neúspěšnou rekanalizací podstoupit operaci koronárního bypassu nebo optimální medikamentózní terapii.
Úspěšná rekanalizace CTO zlepšuje prognózu a kvalitu života pacientů. Po úspěšné rekanalizaci se záchvaty anginy neopakují, zlepšuje se ejekční frakce levé komory a potřeba
operace koronárního bypassu. Data z velkých registrů podporují fakt, že úspěšná rekanalizace CTO zlepšuje dlouhodobou prognózu ve srovnání s neúspěšnou koronární angioplastikou chronických uzávěrů. Při implantaci holých kovových stentů (BMS) je restenóza jednou z častých komplikací spojených s rekanalizací CTO.
V dnešní době mají endovaskulární chirurgové ve svém arzenálu lékové stenty, které prokázaly svou účinnost při stentování CTO díky nízkému výskytu restenóz (2-11 %) a opakovaných okluzí (0-4 %), což má pozitivní vliv na dlouhodobou prognózu těchto pacientů.
Prediktory neúspěšné rekanalizace ČTÚ.
V roce 1995 Rita J.A. a kol. ve svém článku o rekanalizaci CHO zaznamenali několik angiografických prediktorů neúspěšné rekanalizace chronických okluzí.
Autoři zahrnuli takové prediktory jako: rozšířené okluze; přítomnost výrazné kalcifikace v oblasti uzávěru, přítomnost „můstkových“ kolaterál (kolaterály mezi proximální a distální částí uzavřené tepny), plochý tvar pahýlu uzavřené tepny (na rozdíl od kuželovitý pahýl), přítomnost postranních větví v místě počátku uzávěru a přítomnost výrazné tortuozity tepny. Díky technologickému pokroku byly vyvinuty specializované vodicí dráty pro průchod chronických okluzí. Použití nových specializovaných nástrojů zkušenými endovaskulárními chirurgy vedlo ke zvýšení míry rekanalizace CTO, a to i přes přítomnost angiografických prediktorů neúspěšné rekanalizace, které byly popsány před více než 15 lety. Mo1e a kol. hodnotili předoperační použití víceřezové počítačové tomografie vedle konvenční koronarografie ke stanovení prediktorů neúspěšné revaskularizace. Tato studie zahrnovala 49 pacientů. Provedení MSCT koronárních tepen před PCI poskytlo další informace. V multivariační analýze byly identifikovány 3 prediktory neúspěšné rekanalizace CTO: přítomnost
plochý tvar pahýlu okludované tepny identifikovaný pomocí CAG; délka okluze je více než 15 mm a přítomnost těžké kalcifikace podle údajů MSCT.
Patofyziologie uzávěrů.
Histologické vyšetření chronických totálních okluzí (CTO) je důležité pro pochopení organizace okluzí a vývoj technických přístupů ke zvýšení procenta rekanalizací. Okluze do 3 měsíců je bohatá na lipidy a má „měkčí“ obal ve srovnání s chronickými okluzemi, což usnadňuje průchod intrakoronárního vodiče přes místo okluze. Organizovanější CCA obsahuje husté vláknité inkluze a má výraznou kalcifikaci (obr. 1). CTO vzniká po ruptuře aterosklerotického plátu s tvorbou krevní sraženiny. V případě akutního uzávěru věnčité tepny hovoříme o nevratném poškození myokardu v oblasti prokrvení této věnčité tepny. Proto je nutná urgentní perkutánní koronární intervence (PCI) nebo podání trombolytika. Je také možné vyvinout okluzi v oblasti dlouhodobě existující a postupně se zvyšující stenózy. V tomto případě se vytvoří kolaterální síť a obstrukce koronárních tepen nemusí být doprovázena fokálním poškozením myokardu.
Postupem času jsou relativně „měkké“ tromby a lipidové inkluze nahrazeny kolagenem s hustou vazivovou tkání umístěnou na proximálním a distálním konci okluze - tzv. tegmentum. Přibližně po roce se oblast okluze zvápenatí.
Obrázek 1. Lidské koronární tepny s okluzí v procesu organizace (A) a tepny s organizovanou okluzí (B).
Strana A ukazuje úplnou okluzi v procesu organizace - hranice okluze jsou označeny šipkami. Obrázek ukazuje četné cévní kanály (hvězdičky) různých velikostí zasazené do matrice charakterizované fibrinovým (červeným) a proteoglykanovým (modrozeleným) barvením. Strana B představuje již organizovanou úplnou okluzi. Šipky označují hranice okluze, kde jsou cévní kanály (hvězdičky) obklopeny bohatou kolagenovou matricí (žlutá). Oba řezy byly zhotoveny při 20násobném zvětšení. Obrázky s laskavým svolením Drs Frank D. Kolodgie a Drs Renu Virmani, Ústav patologie americké armády, Washington, DC, USA.
Histologické vyšetření uzávěrů potvrzuje přítomnost mikrocév, které nelze zobrazit z důvodu nízkého rozlišení rutinní CAG (250 μm). Ve skutečnosti více než 75 % uzávěrů detekovaných koronarografií neuzavře zcela lumen koronární tepny podle histologických studií. Mikrocévy jsou zaznamenány na adventicii a médiu a zpravidla probíhají v radiálním směru. Pokud jsou dostatečně vyvinuté, jsou považovány za „mostové kolaterály“. Neovaskularizace je také pozorována u aterosklerotických plátů, stejně jako v trombu, protože se stává více organizovaným. Mikrocévy obvykle dosahují velikosti 100-200 mikronů, i když jejich velikosti mohou dosáhnout 500 mikronů. Hrají zvláště důležitou roli při rekanalizaci CTO, protože jsou umístěny paralelně s okluzí a mohou poskytnout cestu pro průchod intrakoronárních vodicích drátů (vodicí drát 0,014 palce, průměr 360 μm). Strauss a kol. hlášeno
na výsledcích mikrovaskulárního zobrazení s vysokým rozlišením na modelu králičí stehenní tepny pomocí zobrazování magnetickou rezonancí (MRI) a trojrozměrné počítačové mikrotomografie (mikro-CT). Technologie MRI mohou poskytnout prostorové rozlišení až 100-200 µm v jedné rovině. Technika micro-CT se provádí ex-vivo na vyříznutých cévách pomocí nízkoviskózní polymerní sloučeniny (Microfil), která vyplňuje mikrocévy. Mikro-CT zobrazování vyhodnocuje mikrocévy s rozlišením 17 µm. Na základě provedených studií byly identifikovány 4 morfologické složky CCA:
Hustá vazivová tkáň v proximálním tegmentu okluze
Kalcifikace
Mikrocévy
Kryt distální okluze.
Obrázek 2. Koronární angiogramy pacienta B.
Pacient B, 71 let, prodělal v roce 1999 akutní přední infarkt myokardu. V roce 1999 byl proveden koronární bypass pro ischemickou chorobu tří cév (okluze LAD ve středním segmentu; 80% stenóza středního segmentu OA, uzávěr v ústí 2. ATC; uzávěr RCA v r. proximální segment). Od července 2012 došlo k obnovení záchvatů anginy pectoris. V březnu 2013 byla provedena koronarografie, zjištěn chronický uzávěr v proximálním segmentu RCA (A), postokluzní úsek vyplněn přes mezisystémové kolaterály, uzávěr je u ústí zkratu do RCA, zbývající zkraty fungují . Podle údajů ECHO-CG je funkce levé komory 40 % (hypokineze předního a anteroseptálního segmentu LK).
Při výkonu byl použit katétr JR 4-6F Počáteční pokusy o použití intrakoronárního vodiče PT 2 MS (Boston Scientific) byly neúspěšné z důvodu nedostatečné tuhosti hrotu vodiče (B). Rekanalizace byla provedena pomocí intrakoronárního vodiče Miracle 6 (B). Tato technologie vyžaduje rozsáhlé zkušenosti operujícího chirurga a pečlivé používání intrakoronárního vodícího drátu s tuhým hrotem. Vodicí dráty této tuhosti se nejlépe používají pro přímé tepny, protože klikaté tepny mají vysoké riziko perforace. D, E: po předběžné predilaci balónkovým katetrem 3,0 x 20 mm byly postupně instalovány stenty 4,0 x 38 mm a 4,5 x 28 mm v místě okluze. E - výsledek stentování.
Proximální pneumatika.
Přítomnost hustého vláknitého uzávěru ztěžuje zavedení intrakoronárního vodícího drátu, zvláště pokud je tvar okluzního pahýlu plochý. Kromě toho původ bočních větví také ztěžuje průchod vodícího drátu okluzí, protože koronární vodicí drát má tendenci se vychylovat do bočních větví.
Pro úspěšnější rekanalizaci CTO byly vyvinuty speciální intrakoronární vodiče, které lépe procházejí hustým fibrózním krytem okluze. Takové vodiče mohou mít rovné nebo zkosené hroty a jsou klasifikovány podle tuhosti hrotu. Tuhost hrotu intrakoronárního vodícího drátu odpovídá hmotnosti aplikované na hrot v gramech. Příkladem jsou vodiče Miracle (Asahi Intecc, Japonsko), se gradací 3; 4,5; 6 a 12 gramů. Pro srovnání, standardní ohebný vodič má méně než 1 gram hmoty aplikovaný na hrot pro jeho ohnutí, zatímco vodič s průměrnou tuhostí je přibližně 3 gramy. Pokud je váha aplikovaná na hrot k jeho ohnutí větší než 3 gramy, pak je intrakoronární vodicí drát považován za tuhý a takové vodicí dráty by měly být používány s extrémní opatrností. Příkladem intrakoronárního vodiče se zkoseným hrotem je vodič Conquest (Confianza) (Asahi Intecc, Japonsko), což je vodič o průměru 0,35 mm se zkoseným hrotem 0,23 mm a zatížením hrotu 9 gramů. stejně jako Cross-it (Abbott Vascular) se špičkou 0,25 mm a různými stupni tuhosti. Zlepšení průchodu intrakoronárního vodícího drátu lze dosáhnout použitím vodícího katetru se zvýšenou podporou, stejně jako balonkového katetru nebo podpory mikrokatétru. Příklad nedostatečné tuhosti hrotu intrakoronárního vodiče při rekanalizaci CTO je uveden na obrázku 2.
Po projití proximálního tegmenta, zejména u čerstvé okluze, lze zbytek okluze snadno projít pomocí měkčích vodicích drátů. Neměli bychom však zapomínat, že zvápenatělé okluze se mohou stát problémem pro další umístění vodičů.
Kalcifikace.
Okluze mladší než 3 měsíce se vyznačují nízkým stupněm kalcifikace a dokonce i mírnou rotací intrakoronárního vodiče (< 90) может обеспечить его легкое антеградное проведение. ХОКА с выраженным кальцинозом являются значимым барьером для проведения интракоронарного проводника, а при использовании проводников с жестким кончиком, кальций может стать причиной проведения
vodič subintimálně (obr. 3A). Rozsah kalcifikace se nejlépe posoudí víceřezovou počítačovou tomografií spíše než koronarografií. Tento přístup však není racionální vzhledem k vysokým nákladům na studii. Pokud koronární vodič přejde do subintimálního prostoru, lze použít techniku paralelního vodiče. Ponechejte vodič umístěný v subintimálním prostoru a protáhněte další vodič pravým kanálem. Tato technika někdy umožňuje zavedení intrakoronárního vodiče i při těžké kalcifikaci (obr. 3B).
Mikrocévy.
Neovaskularizace je tvorba nových cévních mikrotubulů jak uvnitř okluze, tak v dalších vrstvách cévní stěny (media, adventicie). Počet mikrocév se zvyšuje s „věkem“ okluze. Neovaskularizace u CTO může mít výhody i nevýhody pro provádění rekanalizace. Když dobře vyvinuté mikrocévy probíhají paralelně s okluzí, může to usnadnit průchod intrakoronárního vodícího drátu. Koronární vodicí dráty s hydrofilním povlakem fungují v této situaci dobře, protože tekutinou aktivovaný povlak pomáhá vodícímu drátu snadno procházet kanálem. Tyto mikrocévy mohou nebo nemusí být viditelné na koronarografii. Když CTO vykazuje známky antegrádního toku (TIMI I) centrálním kanálem, jsou nejúčinnější vodicí dráty s hydrofilním povlakem, jako jsou Crosswire NT (Terumo), Shinobi (Cordis Corporation), Whisper a Pilot (Abbott Vascular).
Vodicí dráty se zkosenou špičkou mohou být také použity k průchodu mikrocévami, avšak kvůli jejich křehkosti se zvyšuje riziko perforace těmito vodícími dráty. Přemosťující kolaterály jsou někdy vysoce klikaté a navzdory zdánlivě přijatelnému průměru kolaterálu je také vysoké riziko perforace. Pokud jsou kolaterály tohoto typu identifikovány, je lepší použít vodicí drát s pevnou špičkou a protáhnout jej centrálním kanálem okluze, ignorovat přemosťující kolaterály.
Distální pneumatika.
U rozšířených a klikatých okluzí může být průchod vodícího drátu distální částí okluze obtížný. U takových okluzí je rotace hrotu intrakoronárního vodiče výrazně obtížná. V současné době se aktivně využívá retrográdní
Obrázek 3. Schéma rekanalizace koronární arterie v přítomnosti chronické okluze a těžké kalcifikace.
rekanalizace koronárních tepen. Při retrográdní rekanalizaci přes kolaterály pomocí mikrokatétru je intrakoronární vodič přiveden retrográdně do místa okluze z distální strany. V mnoha studiích tato technika rekanalizace CTO vykazovala relativně dobré výsledky ve srovnání s antegrádní rekanalizací.
Pokud je tuhost hrotu intrakoronárního drátu menší než tuhost kalcifikace, hrot intrakoronárního drátu se vychýlí. Obrázek A ukazuje vychýlení vodícího drátu do subintimálního prostoru. Pomocí dvou vodičů. Na obrázku B: první vodič je umístěn v subintimálním prostoru, jako by „blokoval“ vstup do falešného kanálu. Druhý vodič by měl probíhat paralelně s prvním podél pravého kanálu skrz okluzi. V této situaci může použití druhého intrakoronárního vodícího drátu s tužším a zkoseným hrotem zlepšit výsledky rekanalizace koronárních tepen, a to i při těžké kalcifikaci.
Účinnost implantace lékových stentů.
Dlouhodobé výsledky po stentování CTO ukazují vyšší procento restenózy ve srovnání se stentováním neuzavřených tepen. Některé randomizované studie prokázaly významný rozdíl mezi implantací stentu a balónkovou angioplastikou (TBCA) u pacientů po rekanalizaci koronární tepny. Publikovaná metaanalýza těchto studií
nevykazuje žádný rozdíl v mortalitě (0,4 % ve skupině s BMC stentingem a 0,7 % ve skupině s pouze TBCA (HR 0,72, 95% CI, 0,21-2,50). Stentování je spojeno s významně nižší mortalitou hodin velkých nežádoucích srdečních příhod (MACE ): 23,2 % ve skupině se stentováním ve srovnání s 35,4 % ve skupině s TBCA,
RR 0,49, 95% CI 0,36-0,68 kvůli menšímu počtu opakovaných revaskularizací (17 % ve skupině se stentováním vs. 32 % ve skupině s TBCA,
RR 0,4, CI 95 % 0,31-0,53).
Byly publikovány výsledky řady registrů implantací lékových stentů a BMS (tab. 1 a 2). Ve studiích byly použity stenty uvolňující sirolimus (SES) a pacli-taxel (PES). Ve skupině se stentem uvolňujícím lék se vyskytlo významně méně nežádoucích účinků, četnosti restenóz a potřeby revaskularizace cílové léze. Údaje ze studií potvrdily účinnost SES ve srovnání s BMS. Podle studie PRISON II tedy byla míra revaskularizace v cílové oblasti léze 12 % pro SES ve srovnání s 30 % pro BMS, p = 0,001; revaskularizace cílových cév 17 % pro SES versus 34 % pro BMS, p=0,009; míra nežádoucích kardiovaskulárních příhod (MACE) 12 % pro SES versus 36 % pro BMS, str<0,001.
S přihlédnutím k výsledkům všech těchto studií je míra revaskularizace cílových cév významně nižší ve skupině pacientů se stenty uvolňujícími léky (obr. 4).
Pokud jde o volbu lékového stentu pro CTO, můžeme uvést nedávno publikovanou studii PRISON III - multicentrickou, randomizovanou studii,
včetně 304 pacientů. Tato studie hodnotila stenty uvolňující sirolimus (SES) a stenty uvolňující zotaralimus (ZES). Navíc byla skupina potažená zotaralimem rozdělena do 2 podskupin: pacienti se stenty Endeavour (Medtronic, USA) a pacienti se stenty Resolute (Medtronic, USA). Primárním cílovým parametrem byla pozdní ztráta lumen po osmi měsících sledování.
Po osmi měsících měli pacienti ve skupině SES menší pozdní ztrátu segmentu a stentu ve srovnání se skupinou SES: -0,13±0,3 mm oproti 0,27±0,6 mm (p=0,0002) a -0,13±0,5 mm oproti 0,54±0,5 mm (str<0,0001), соответственно. В группе SES и в группе ZES результаты оказались сопоставимы по потере просвета в сегменте -0,03±0,7 мм против -0,10±0,7 мм, p=0,6 и в стенте 0,03±0,8 мм против 0,05±0,8 мм, p=0,9.
Po 12 měsících sledování nebyl signifikantní rozdíl v počtu závažných nežádoucích kardiovaskulárních příhod ve skupině SES a ve skupině ZES 11,8 % oproti 15,2 %, p=0,8; revaskularizace v cílové oblasti léze 9,8 % oproti 15,2 %, p=0,5 a selhání cílové cévy 11,8 % oproti 15,2 %, p=0,8. Nebyl také žádný významný rozdíl v počtu MACE ve skupinách SES a ZES: 5,8 % versus 7,7 %, p=0,8; TLR 5,8 % vs 3,8 %, p=0,5; TVR 5,8 % vs 5,8 %, p=1,0, také nebyl rozdíl v trombóze stentu 1,0 % v obou skupinách.
Vlastní data.
Před několika lety byly na oddělení RTG endovaskulární diagnostiky a léčby RK NPC provedeny studie úspěšných rekanalizací. U 208 pacientů s ischemickou chorobou srdeční byly provedeny pokusy o rekanalizaci CTO. 170 pacientů (81,5 %) bylo mužů a 38 (18,5 %) žen. Věk pacientů se pohyboval od 36 do 68 let (průměr 52 let). Délka okluzí je od 1 měsíce do 3 let. 164 pacientů (78,5 %) mělo v anamnéze infarkt myokardu. Vícecévní léze byly zjištěny u 169 pacientů (81,2 %), jednocévní u 37 pacientů (17,8 %). 46 pacientů (22,1 %) mělo „tiché“ okluze se zachovanou kontraktilitou myokardu. Úspěšného obnovení průtoku krve bylo dosaženo u 154 pacientů (74 %). U 58 (26 %) pacientů byla rekanalizace neúspěšná pro nemožnost průchodu intrakoronárního vodiče okluzním krytem Poznámka: BMS – holý kovový stent, MACE – závažné nežádoucí srdeční příhody; ns - nevýznamné; PES - stent uvolňující paclitaxel; SES - stent uvolňující sirolimus; TLR – revaskularizace cílové léze.
Závěr.
Rekanalizace CTO v současnosti zůstává pro mnoho intervenčních kardiologů technicky náročnou intervencí. Ačkoli za posledních 5–10 let mají endovaskulární chirurgové ve svém arzenálu velkou sadu specializovaných koronárních vodičů. Zavedení nových metod a specializovaného přístrojového vybavení umožňuje dosáhnout úspěšné rekanalizace u více než 80 % okluzí v rukou zkušeného operátora.
Histologické studie prokázaly přítomnost mikrocév v oblasti okluzí, což někdy přispívá k příznivé rekanalizaci koronárních tepen. Pro zlepšení výsledků rekanalizace CTO je nejracionálnější pomalu procházet intrakoronárním vodičem okludovanou oblastí. Doporučuje se použít více intrakoronárních vodicích drátů nebo vybrat nejlepší vodicí drát pro konkrétní okluzi. Po průchodu vodícího drátu okluzí a dilataci balónkovým katétrem se doporučuje použít lékové stenty.
Tabulka 1. Schéma rekanalizace koronární tepny v přítomnosti chronické okluze a těžké kalcifikace.
RESEARCH BMS Register Milan BMS PRISON II BMS Nakamura a spol. BMS Werner a spol. BMS T-search PES
BMS SES P BMS SES P BMS SES P BMS SES P BMS SES P
Počet pacientů 28 56 259 122 100 100 120 60 48 48 57
Délka pozorování (měsíce) 12 12 6 6 60 60 12 12 12 1 2 12
Klinické výsledky
Smrt (%) 0 0 - 1 3 0,61 5 5 1,0 0 0 - 4 2 Ns 2
MI (%) 0 2 Ns 8 8 0,97 7 8 0,8 3 0 Ns 2 4 Ns 2
TLR (%) 18 4<0,05 26 7 <0,001 27 12 0,006 42 3 0,001 44 6 <0,001 4
MACE (%) 18 4<0,05 35 16 <0,001 36 12 0,001 42 3 0,001 48 13 <0,001 7
30denní trombóza stentu 0 2 Ns 0,4 0 0,70 1 7 Ns 0 0 - 0 0 - 0
Poznámka: V MS - holý kovový stent; MACE - hlavní nežádoucí srdeční příhody; ns - nevýznamné; PES - stent; potažené pacpitaxelem; SES - stent; potažené sirolimem; TLR – revaskularizace cílové léze.
ATEROSKLERÓZA A DYSLIPIDEMIE
Obrázek 4. Riziko potřeby opakované revaskularizace u pacientů podstupujících stenty uvolňující léky (DEES) oproti stentům s holýmavým povrchem (BMS) v každé studii a v celkové populaci s RR a 95% CI.
Studie DES (n|N) BMS (n|N) RR (náhodné) 95 % DT Podíl vzorku v % RR (náhodné) 95 % DT
Hoye a všichni|В 1/56 5/28< ■ ■ -* I -■-г I -■- V I I 4.10 0.08
Kim et allIG 1 /54 10/79 4,56 0,13
Ge et all17 11/122 75/259 43,57 0,24
Nakamura et all12 2/60 51/120 9,38 0,05
Suttorp et all15 8/100 22/100 26,64 0,31
Werner et all15 3/48 21/48 11,75 0,09
Celkem (95% CI) 440 634 100 0,18
Celkový počet událostí: 26 (REB), 184 (WMB) Celkové hodnocení účinku: 7=7,48, (p<0.00001)
0.01 0.1 1 10 100
Tabulka 2. Souhrn angiografických výsledků z publikovaných studií, které hodnotily implantaci stentů uvolňujících léčivo pro chronické totální okluze.
VÝZKUMNÝ registr)